
Propriedades, estrutura e usos do ácido sulfúrico (H2SO4)
O ácido sulfúrico (HdoisSW4) É um composto químico líquido, oleoso e incolor, solúvel em água com liberação de calor e corrosivo para metais e tecidos. Carboniza a madeira e a maior parte da matéria orgânica em contato com ela, mas é improvável que cause um incêndio.
O ácido sulfúrico é talvez o mais importante de todos os produtos químicos industriais pesados e seu consumo foi citado várias vezes como um indicador do estado geral da economia de uma nação..

A exposição de longo prazo a baixas concentrações ou a exposição de curto prazo a altas concentrações pode resultar em efeitos adversos à saúde. De longe, o uso mais importante do ácido sulfúrico é na indústria de fertilizantes fosfatados.
Outras aplicações importantes são no refino de petróleo, produção de pigmentos, decapagem de aço, extração de metais não ferrosos e fabricação de explosivos, detergentes, plásticos, fibras sintéticas e farmacêuticas..
Índice do artigo
- 1 Vitríolo, o antecedente do ácido sulfúrico
- 2 Fórmula
- 3 Estrutura química
- 3.1 Em 2D
- 3.2 Em 3D
- 4 recursos
- 4.1 Propriedades físicas e químicas
- 4.2 Reações com ar e água
- 4.3 Inflamabilidade
- 4.4 Reatividade
- 4.5 Toxicidade
- 5 usos
- 5.1 indireto
- 5.2 Direto
- 6 O desenvolvimento da indústria de ácido sulfúrico
- 6.1 Processo de Vitríolo
- 6.2 Câmaras de chumbo
- 7 Produção atual: processo de contato
- 7.1 Processo de duplo contato
- 8 Matérias-primas utilizadas na produção de ácido sulfúrico
- 8.1 Pirita
- 8.2 Dióxido de enxofre
- 8.3 Reciclado
- 9 efeitos clínicos
- 10 Segurança e Riscos
- 10.1 Classes de perigo GHS
- 10.2 Códigos de declaração de precaução
- 11 referências
Vitríolo, o antecedente do ácido sulfúrico
Na Europa medieval, o ácido sulfúrico era conhecido como vitríolo, óleo de vitríolo ou licor de vitríolo pelos alquimistas. Foi considerada a substância química mais importante e foi testada para ser usada como pedra filosofal.
Os sumérios já tinham uma lista de vários tipos de vitríolo. Além disso, Galeno, o médico grego Dioscórides e Plínio, o Velho, levantou seu uso médico.

Nos trabalhos alquímicos helenísticos, os usos metalúrgicos de substâncias vitriólicas já foram mencionados. O vitríolo é um grupo de minerais vítreos a partir dos quais o ácido sulfúrico pode ser obtido.
Fórmula
-Fórmula: HdoisSW4
-Número CAS: 7664-93-9
Estrutura química
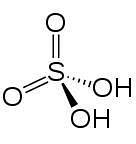
Em 2D
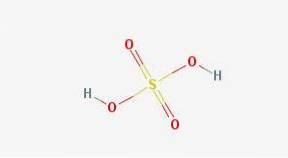
Em 3d
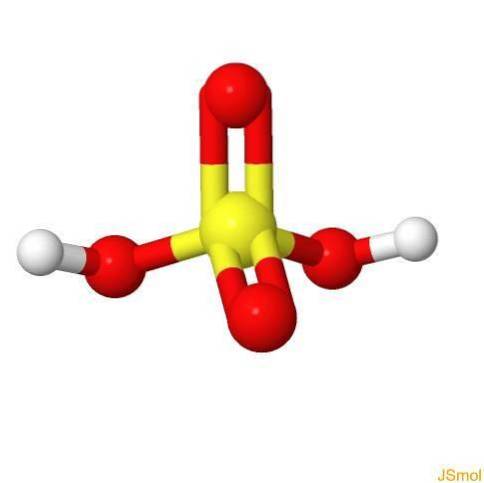
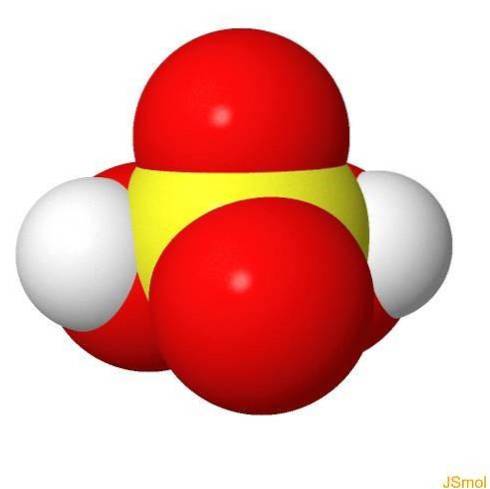
Caracteristicas
Propriedades físicas e químicas

O ácido sulfúrico pertence ao grupo reativo de ácidos oxidantes fortes.
Reações com ar e água
- A reação com água é insignificante, a menos que a acidez esteja acima de 80-90%, então o calor da hidrólise é extremo, pode causar queimaduras graves.
Inflamabilidade
- Os ácidos oxidantes fortes geralmente não são inflamáveis. Eles podem acelerar a combustão de outros materiais, fornecendo oxigênio para o local de combustão.
- No entanto, o ácido sulfúrico é altamente reativo e capaz de inflamar materiais combustíveis finamente divididos quando em contato com eles..
- Quando aquecido, ele emite vapores altamente tóxicos.
- É explosivo ou incompatível com uma grande variedade de substâncias.
- Pode sofrer violentas mudanças químicas em altas temperaturas e pressão.
- Pode reagir violentamente com água.
Reatividade
- O ácido sulfúrico é fortemente ácido.
- Reage violentamente com pentafluoreto de bromo.
- Explodir com para-nitrotolueno a 80 ° C.
- Uma explosão ocorre quando o ácido sulfúrico concentrado é misturado com o permanganato de potássio cristalino em um recipiente que contém umidade. Forma-se heptoóxido de manganês, que explode a 70 ° C.
- A mistura de acrilonitrila com ácido sulfúrico concentrado deve ser mantida bem refrigerada, caso contrário, ocorre uma reação exotérmica vigorosa.
- A temperatura e a pressão aumentam quando o ácido sulfúrico (96%) é misturado em porções iguais em um recipiente fechado com qualquer uma das seguintes substâncias: acetonitrila, acroleína, 2-aminoetanol, hidróxido de amônio (28%), anilina, n-butiraldeído, clorossulfônico ácido, etileno diamina, etilenoimina, epiclorohidrina, etileno cianohidrina, ácido clorídrico (36%), ácido fluorídrico (48,7%), óxido de propileno, hidróxido de sódio, monômero de estireno.
- O ácido sulfúrico (concentrado) é extremamente perigoso em contato com carbonetos, bromatos, cloratos, primários, picratos e metais em pó..
- Pode induzir polimerização violenta de cloreto de alila e reage exotermicamente com hipoclorito de sódio para produzir cloro gasoso.
- A mistura de ácido clorossulfúrico e ácido sulfúrico 98% dá HCl.
Toxicidade
- O ácido sulfúrico é corrosivo para todos os tecidos do corpo. A inalação de vapor pode causar sérios danos aos pulmões. O contato com os olhos pode resultar na perda total da visão. O contato com a pele pode causar necrose severa.
- A ingestão de ácido sulfúrico, em uma quantidade entre 1 colher de chá e meia onça do produto químico concentrado, pode ser fatal para um adulto. Mesmo algumas gotas podem ser fatais se o ácido entrar na traqueia.
- A exposição crônica pode causar traqueobronquite, estomatite, conjuntivite e gastrite. Perfuração gástrica e peritonite podem ocorrer e podem ser seguidas por colapso circulatório. O choque circulatório costuma ser a causa imediata da morte.
- Pessoas com doenças respiratórias, gastrointestinais ou nervosas crônicas e quaisquer doenças dos olhos e da pele correm maior risco.
Formulários
- O ácido sulfúrico é um dos produtos químicos industriais mais amplamente usados no mundo. Mas, a maioria de seus usos pode ser considerada indireta, participando como um reagente ao invés de um ingrediente.
- A maior parte do ácido sulfúrico acaba como o ácido gasto na produção de outros compostos, ou como algum tipo de resíduo de sulfato.
- Vários produtos incorporam enxofre ou ácido sulfúrico, mas quase todos são produtos especiais de baixo volume..
- Cerca de 19% do ácido sulfúrico produzido em 2014 foi consumido em cerca de vinte processos químicos, e o restante foi consumido em uma ampla variedade de aplicações industriais e técnicas.
- O crescimento da demanda por ácido sulfúrico em todo o mundo se deve, em ordem decrescente, à produção de: ácido fosfórico, dióxido de titânio, ácido fluorídrico, sulfato de amônio e no processamento de urânio e aplicações metalúrgicas.
Indireto
- O maior consumidor de ácido sulfúrico é, de longe, a indústria de fertilizantes. Representou pouco mais de 58% do consumo mundial total em 2014. No entanto, essa proporção deve diminuir para aproximadamente 56% até 2019, principalmente como resultado do maior crescimento em outras aplicações químicas e industriais..
- A produção de materiais fertilizantes fosfatados, especialmente ácido fosfórico, é o principal mercado para o ácido sulfúrico. Ele também é usado para a fabricação de materiais fertilizantes, como superfosfato triplo e fosfatos mono e diamônio. Quantidades menores são usadas para a produção de superfosfato e sulfato de amônio.
- Em outras aplicações industriais, quantidades substanciais de ácido sulfúrico são usadas como meio de reação de desidratação de ácido, em química orgânica e processos petroquímicos envolvendo reações como nitração, condensação e desidratação, bem como no refino de petróleo., Onde é usado no refino, alquilação e purificação de destilados brutos.
- Na indústria química inorgânica, seu uso é notável na produção de pigmentos de TiO2, ácido clorídrico e ácido fluorídrico..
- Na indústria de processamento de metal, o ácido sulfúrico é usado para decapagem de aço, lixiviação de minérios de cobre, urânio e vanádio no processamento hidrometalúrgico de minerais e na preparação de banhos eletrolíticos para a purificação e revestimento de metais. ferroso.
- Certos processos de fabricação de polpa de madeira na indústria de papel, na produção de alguns têxteis, na fabricação de fibras químicas e no curtimento de peles, também requerem ácido sulfúrico.
Direto
- Provavelmente, o maior uso do ácido sulfúrico, no qual o enxofre é incorporado ao produto final, é no processo de sulfonação orgânica, principalmente para a produção de detergentes..
- A sulfonação também desempenha um papel importante na obtenção de outros produtos químicos orgânicos e produtos farmacêuticos menores..
- As baterias de chumbo-ácido são um dos produtos de consumo contendo ácido sulfúrico mais conhecidos, respondendo por apenas uma pequena fração do consumo total de ácido sulfúrico..
- Sob certas condições, o ácido sulfúrico é usado diretamente na agricultura para a reabilitação de solos altamente alcalinos, como os encontrados nas regiões desérticas do oeste dos Estados Unidos. No entanto, este uso não é muito importante em termos do volume total de ácido sulfúrico utilizado..
O desenvolvimento da indústria de ácido sulfúrico
Processo de vitríolo

O método mais antigo de obtenção do ácido sulfúrico é o chamado “processo do vitríolo”, que se baseia na decomposição térmica dos vitrióis, que são sulfatos de vários tipos, de origem natural..
Os alquimistas persas, Jābir ibn Hayyān (também conhecido como Geber, 721 - 815 DC), Razi (865 - 925 DC) e Jamal Din al-Watwat (1318 DC), incluíram o vitríolo em suas listas de classificação de minerais.
A primeira menção ao "processo vitríolo" aparece nos escritos de Jabir ibn Hayyan. Em seguida, os alquimistas Santo Alberto o Grande e Basílio Valentino descreveram o processo com mais detalhes. Alumínio e calcantita (vitríolo azul) foram usados como matérias-primas.
No final da Idade Média, o ácido sulfúrico era obtido em pequenas quantidades em recipientes de vidro, nos quais o enxofre era queimado com salitre em ambiente úmido..
O processo do vitríolo foi utilizado em escala industrial a partir do século 16 devido a uma maior demanda por ácido sulfúrico.
Vitríolo de Nordhausen
O foco da produção estava na cidade alemã de Nordhausen (por isso o vitríolo passou a ser chamado de “vitríolo Nordhausen”), onde sulfato de ferro (II) (vitríolo verde, FeSO4 - 7hdoisO) como matéria-prima, que foi aquecida, e o trióxido de enxofre resultante foi misturado com água para obter ácido sulfúrico (óleo de vitríolo).
O processo foi realizado em cozinhas, algumas das quais possuíam vários níveis, em paralelo, a fim de se obter maiores quantidades de óleo de vitríolo..
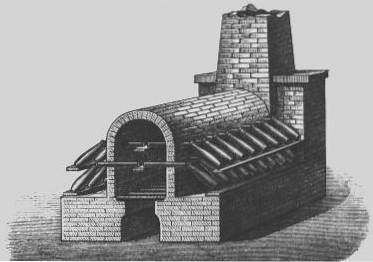
Câmaras de chumbo
No século 18, um processo mais econômico para a produção de ácido sulfúrico foi desenvolvido, conhecido como “processo de câmara de chumbo”.
Até então, a concentração máxima de ácido obtida era de 78%, enquanto com o "processo do vitríolo" se obtinham ácido concentrado e oleum, portanto este método continuou a ser utilizado em determinados setores da indústria até o surgimento do "processo de contato" em 1870, com o qual o ácido concentrado poderia ser obtido mais barato.
Óleo ou ácido sulfúrico fumante (CAS: 8014-95-7), é uma solução de consistência oleosa e cor marrom escura, com composição variável de trióxido de enxofre e ácido sulfúrico, que pode ser descrita pela fórmula HdoisSW4.xSO3 (onde x representa o conteúdo molar livre de óxido de enxofre (VI)). Um valor para x de 1 dá a fórmula empírica HdoisSdoisOU7, correspondendo ao ácido dissulfúrico (ou ácido pirossulfúrico).
Processar
O processo de câmara de chumbo era o método industrial utilizado para produzir ácido sulfúrico em grandes quantidades, antes de ser suplantado pelo "processo de contato".
Em 1746, em Birmingham, Inglaterra, John Roebuck começou a produzir ácido sulfúrico em câmaras revestidas de chumbo, que eram mais fortes e mais baratas do que os recipientes de vidro usados anteriormente, e podiam ser muito maiores.
O dióxido de enxofre (proveniente da combustão de enxofre elementar ou minerais metálicos contendo enxofre, como a pirita) foi introduzido com vapor e óxido de nitrogênio em grandes câmaras revestidas com folhas de chumbo..
O dióxido de enxofre e o dióxido de nitrogênio foram dissolvidos e, durante um período de aproximadamente 30 minutos, o dióxido de enxofre foi oxidado a ácido sulfúrico..
Isso permitiu a industrialização efetiva da produção de ácido sulfúrico e, com vários refinamentos, esse processo permaneceu o método padrão de produção por quase dois séculos..
Em 1793, Clemente e Desormes alcançaram melhores resultados ao introduzir ar suplementar no processo da câmara de chumbo..
Em 1827, Gay-Lussac introduziu um método de absorção de óxidos de nitrogênio dos gases residuais da câmara de chumbo..
Em 1859, Glover desenvolveu um método para a recuperação de óxidos de nitrogênio a partir do ácido recém-formado, por separação com gases quentes, que possibilitou realizar o processo de catalisação do óxido de nitrogênio de forma contínua..
Em 1923, Petersen introduziu um processo de torre aprimorado que lhe permitiu ser competitivo com o processo de contato até a década de 1950..
O processo de câmara tornou-se tão robusto que em 1946 ainda representava 25% da produção mundial de ácido sulfúrico..
Produção atual: processo de contato
O processo de contato é o método atual de produção de ácido sulfúrico em altas concentrações, necessário nos processos industriais modernos. A platina costumava ser o catalisador dessa reação. No entanto, pentóxido de vanádio (V2O5) agora é preferido.
Em 1831, em Bristol, Inglaterra, Peregrine Phillips patenteou a oxidação do dióxido de enxofre em trióxido de enxofre usando um catalisador de platina a temperaturas elevadas..
No entanto, a adoção de sua invenção e o desenvolvimento intensivo do processo de contato começaram somente depois que a demanda por oleum para a fabricação de corantes aumentou a partir de cerca de 1872..
Em seguida, os melhores catalisadores sólidos foram pesquisados e a química e a termodinâmica do equilíbrio SO2 / SO3 foram investigadas..
O processo de contato pode ser dividido em cinco etapas:
- Combinação de enxofre e dioxigênio (O2) para formar dióxido de enxofre.
- Purificação de dióxido de enxofre em uma unidade de purificação.
- Adição de excesso de dioxigênio ao dióxido de enxofre na presença de catalisador de pentóxido de vanádio, a temperaturas de 450 ° C e pressão de 1-2 atm.
- O trióxido de enxofre formado é adicionado ao ácido sulfúrico dando origem ao oleum (ácido dissulfúrico).
- Oleum é então adicionado à água para formar ácido sulfúrico, que é altamente concentrado..
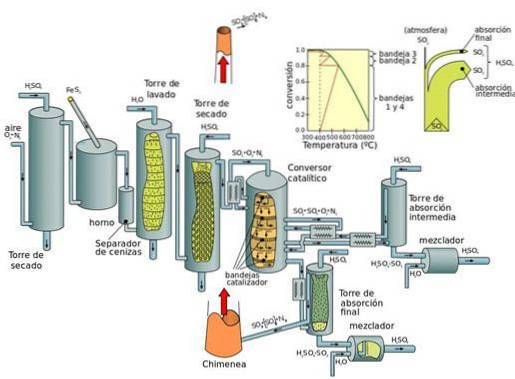
A desvantagem fundamental dos processos de óxido de nitrogênio (durante o processo de câmara de chumbo) é que a concentração de ácido sulfúrico obtida é limitada a um máximo de 70 a 75%, enquanto o processo de contato produz ácido concentrado (98%).
Com o desenvolvimento de catalisadores de vanádio relativamente baratos para o processo de contato, juntamente com a crescente demanda por ácido sulfúrico concentrado, a produção global de ácido sulfúrico em fábricas de processamento de óxido de nitrogênio diminuiu continuamente..
Em 1980, praticamente nenhum ácido era produzido nas fábricas de processamento de óxido de nitrogênio na Europa Ocidental e na América do Norte.
Processo de duplo contato
O processo de dupla absorção de contato duplo (DCDA ou Double Contact Double Absorption) introduziu melhorias no processo de contato para a produção de ácido sulfúrico.
Em 1960, a Bayer solicitou uma patente para o chamado processo de catálise dupla. A primeira planta a usar este processo foi iniciada em 1964.
Ao incorporar um estágio de absorção de SO3 Antes dos estágios catalíticos finais, o processo de contato aprimorado permitiu um aumento significativo na conversão de SO.dois , reduzindo substancialmente suas emissões para a atmosfera.
Os gases são repassados pela coluna de absorção final, obtendo não apenas um alto desempenho de conversão de SOdois para então3 (de aproximadamente 99,8%), mas também permitindo a produção de uma concentração maior de ácido sulfúrico.
A diferença essencial entre esse processo e o processo de contato comum está no número de estágios de absorção..
A partir dos anos 1970, os principais países industrializados introduziram regulamentações mais rígidas para a proteção do meio ambiente, e o processo de double takeover tornou-se mais difundido em novas fábricas. No entanto, o processo de contato convencional ainda é usado em muitos países em desenvolvimento com padrões ambientais menos rigorosos..
O maior impulso para o desenvolvimento atual do processo de contato está focado em aumentar a recuperação e aproveitamento da grande quantidade de energia produzida no processo..
Na verdade, uma grande e moderna usina de ácido sulfúrico pode ser vista não apenas como uma usina química, mas também como uma usina termelétrica..
Matérias-primas utilizadas na produção de ácido sulfúrico
Pirita
A pirita foi a matéria-prima dominante na produção de ácido sulfúrico até meados do século 20, quando grandes quantidades de enxofre elementar começaram a ser recuperadas do processo de refino de petróleo e purificação do gás natural, tornando-se o principal material premium da indústria.
Dióxido de enxofre
Atualmente, o dióxido de enxofre é obtido por diferentes métodos, a partir de diversas matérias-primas.
Nos Estados Unidos, a indústria tem se baseado desde os primeiros anos do século 20 na obtenção de enxofre elementar de depósitos subterrâneos pelo "Processo de Frasch".
O ácido sulfúrico moderadamente concentrado também é produzido pela reconcentração e purificação de grandes quantidades de ácido sulfúrico obtido como subproduto de outros processos industriais..
Reciclando
A reciclagem desse ácido é cada vez mais importante do ponto de vista do meio ambiente, principalmente nos principais países desenvolvidos..
A fabricação de ácido sulfúrico com base em enxofre elementar e pirita é, obviamente, relativamente sensível às condições de mercado, uma vez que o ácido produzido a partir desses materiais representa um produto primário..
Em contraste, quando o ácido sulfúrico é um subproduto, fabricado como meio de remoção de resíduos de outro processo, o nível de sua produção não é ditado pelas condições do mercado de ácido sulfúrico, mas pelas condições de mercado para o produto primário.
Efeitos clínicos
-O ácido sulfúrico é usado na indústria e em alguns produtos de limpeza doméstica, como limpadores de banheiro. Também usado em baterias.
-A ingestão deliberada, principalmente de produtos altamente concentrados, pode causar ferimentos graves e morte. Essas exposições à ingestão são raras nos Estados Unidos, mas prevalecem em outras partes do mundo..
-É um ácido forte que causa danos aos tecidos e coagulação das proteínas. É corrosivo para a pele, olhos, nariz, membranas mucosas, trato respiratório e trato gastrointestinal ou qualquer tecido com o qual entre em contato..
-A gravidade da lesão é determinada pela concentração e duração do contato.
-Exposições mais leves (concentrações menores que 10%) causam irritação apenas na pele, trato respiratório superior e mucosa gastrointestinal.
-Os efeitos respiratórios da exposição aguda à inalação incluem: irritação do nariz e da garganta, tosse, espirros, broncoespasmo reflexo, dispneia e edema pulmonar. A morte pode ocorrer por colapso circulatório súbito, edema de glote e envolvimento das vias aéreas ou lesão pulmonar aguda.
-A ingestão de ácido sulfúrico pode causar dor epigástrica imediata, náusea, salivação e vômito de material mucoide ou hemorrágico que se parece com “borra de café”. Ocasionalmente, vômito de sangue fresco é observado.
-A ingestão de ácido sulfúrico concentrado pode levar à corrosão do esôfago, necrose e perfuração do esôfago ou estômago, especialmente no piloro. Ocasionalmente, é observada lesão no intestino delgado. As complicações posteriores podem incluir estenose e formação de fístula. Após a ingestão, pode desenvolver acidose metabólica.
-Podem ocorrer queimaduras graves na pele com necrose e cicatrizes. Isso pode ser fatal se uma área grande o suficiente da superfície corporal for afetada..
-O olho é especialmente sensível a lesões por corrosão. Irritação, lacrimejamento e conjuntivite podem ocorrer mesmo com baixas concentrações de ácido sulfúrico. Respingos de ácido sulfúrico em altas concentrações causam: queimaduras na córnea, perda de visão e, ocasionalmente, perfuração do globo.
-A exposição crônica pode estar associada a alterações na função pulmonar, bronquite crônica, conjuntivite, enfisema, infecções respiratórias frequentes, gastrite, erosão do esmalte dentário e, possivelmente, câncer do trato respiratório..
Segurança e Riscos
Declarações de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (GHS)
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema acordado internacionalmente, criado pelas Nações Unidas, projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países, usando critérios consistentes em nível global (Nações Unidas, 2015 ).
As classes de perigo (e seu capítulo GHS correspondente), padrões de classificação e rotulagem e recomendações para ácido sulfúrico são as seguintes (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Classes de perigo GHS
H303: Pode ser prejudicial se ingerido [Aviso Toxicidade aguda, oral - Categoria 5] (PubChem, 2017).
H314: Provoca queimaduras na pele e lesões oculares graves [Perigo corrosão / irritação cutânea - Categoria 1A, B, C] (PubChem, 2017).
H318: Causa lesões oculares graves [Perigo Lesões oculares graves / irritação ocular - Categoria 1] (PubChem, 2017).
H330: Fatal por inalação [Toxicidade aguda de perigo, inalação - Categoria 1, 2] (PubChem, 2017).
H370: Causa danos aos órgãos [Toxicidade para órgãos-alvo específicos de perigo, exposição única - Categoria 1] (PubChem, 2017).
H372: Causa danos aos órgãos por exposição repetida ou prolongada [Toxicidade para órgãos-alvo específicos de perigo, exposição repetida - Categoria 1] (PubChem, 2017).
H402: Nocivo para a vida aquática [Perigoso para o ambiente aquático, perigo agudo - Categoria 3] (PubChem, 2017).
Códigos de declaração de precaução
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P321, P321, P363, P403 + P233, P405 e P501 (PubChem, 2017).
Referências
- Arribas, H. (2012) Diagrama da produção de ácido sulfúrico pelo método de contato usando pirita como matéria-prima [imagem] Recuperado de wikipedia.org.
- Chemical Economics Handbook, (2017). Ácido sulfúrico. Recuperado de ihs.com.
- Chemical Economics Handbook, (2017.) Consumo mundial de ácido sulfúrico - 2013 [imagem]. Recuperado de ihs.com.
- ChemIDplus, (2017). Estrutura 3D de 7664-93-9 - ácido sulfúrico [imagem] Recuperado de: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Retrato de "Geber" do século XV. Biblioteca Laurenziana Medicea [imagem]. Recuperado de wikipedia.org.
- Agência Europeia dos Produtos Químicos (ECHA), (2017). Resumo da classificação e rotulagem. Classificação harmonizada - Anexo VI do Regulamento (CE) n.º 1272/2008 (Regulamento CLP).
- Banco de dados de substâncias perigosas (HSDB). TOXNET. (2017). Ácido sulfúrico. Bethesda, MD, EU: National Library of Medicine. Recuperado de: toxnet.nlm.nih.gov.
- Leyo (2007) Fórmula esquelética do ácido sulfúrico [imagem]. Recuperado de: commons.wikimedia.org.
- Extrato da Companhia de Carne de Liebig (1929) Albertus Magnus, Chimistes Celebres [imagem]. Recuperado de: wikipedia.org.
- Müller, H. (2000). Ácido sulfúrico e trióxido de enxofre. Na Enciclopédia de Química Industrial de Ullmann. Wiley-VCH Verlag GmbH & Co. KGaA. Disponível em: doi.org.
- Nações Unidas (2015). Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) Sexta edição revisada. Nova York, UE: Publicação das Nações Unidas. Recuperado de: unece.org.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database, (2017). Ácido sulfúrico - Estrutura PubChem. [imagem] Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database, (2017). Ácido sulfúrico. Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados química. Ácido sulfúrico, gasto. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados química. Ácido sulfúrico. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados do grupo reativo. Ácidos Fortes Oxidantes. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov.
- Oelen, W. (2011) Ácido sulfúrico 96 por cento extra puro [imagem]. Recuperado de: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [imagem]. Recuperado de: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, em: Chemie in unserer Zeit. [foto]. Recuperado de: wikipedia.org.
- Stephanb (2006) Sulfato de cobre [imagem]. Recuperado de: wikipedia.org.
- Stolz, D. (1614) Alchemical diagram. Theatrum Chymicum [imagem] Recuperado de: wikipedia.org.
- Wikipedia, (2017). Ácido sulfúrico. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Ácido sulfúrico. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Processo de contato. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Processo de câmara de chumbo. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Oleum. Recuperado de: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Recuperado de: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Óxido de enxofre Recuperado de: wikipedia.org.
- Wikipedia, (2017). Processo de vitríolo. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Dióxido de enxofre. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Trióxido de enxofre. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Ácido sulfúrico. Recuperado de: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Recuperado de: wikipedia.org.
- Wright, J. (1770) O Alquimista, Em Busca da Pedra Filosofal, Descobre Fósforo e ora pela conclusão bem-sucedida de sua operação, como era o costume dos Antigos Astrólogos Químicos. [imagem] Recuperado de: wikipedia.org.

Ainda sem comentários