
Síntese do ácido fenoxiacético, procedimento, usos, riscos

O ácido fenoxiacético É uma substância de natureza orgânica, formada pela reação entre o fenol e o ácido monocloroacético na presença de uma solução de hidróxido de sódio. O procedimento usado para obter este produto é denominado síntese de éteres de Williamson..
O ácido fenoxiacético sintetizado é um precipitado branco ou incolor, formado por cristais em forma de agulha, praticamente insolúvel em água (solubilidade em água 12 g / l-1), mas solúvel em ácido acético, fenol e éter dietílico.
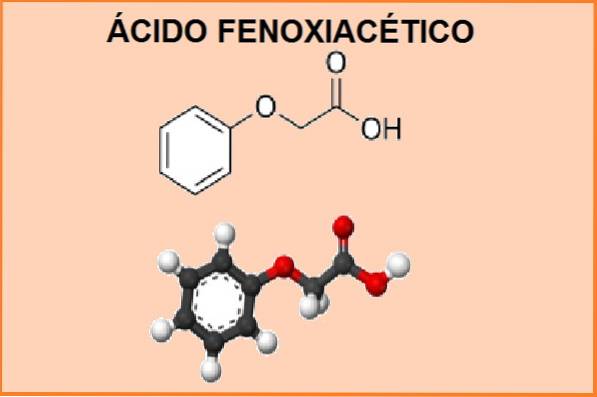
Seu nome químico é 2-fenoxietanóico e sua fórmula molecular é C8 H8 OU3. A massa molecular é 152,15 g.mol-1. Este produto se comporta como um ácido fraco e tem um ponto de fusão entre 98 a 100 ° C e um ponto de ebulição de 285 ° C.
O ácido fenoxiacético é um produto intermediário na síntese de substâncias com propriedades herbicidas. Por si só, o ácido fenoxiacético tem propriedades antifúngicas contra Candida albicans e Trichophyton rubrum. Também é útil como esfoliante da pele, removendo o excesso de queratina nos calosidades.
É necessário tomar precauções no seu manuseio, pois quando aquecido emite gases tóxicos e corrosivos. Entre os gases está o cloreto de hidrogênio.
A exposição direta a este produto pode causar leve irritação da pele ou mucosa, embora não de grande importância, exceto pela afetação da mucosa ocular, pode ser grave. Também causa irritação do trato respiratório se inalado e do trato gástrico se ingerido..
É uma substância não inflamável e bastante estável à temperatura ambiente, porém, em altas temperaturas ou pressões pode perder sua estabilidade, e quando confrontada com a água pode liberar uma certa quantidade de energia, mas não o fará de forma violenta..
Índice do artigo
- 1 Síntese de ácido fenoxiacético
- 2 Procedimento
- 2.1 Etapa 1
- 2.2 Etapa 2
- 2.3 Etapa 3
- 2.4 Etapa 4
- 2.5 Etapa 5
- 2.6 Etapa 6
- 2.7 Etapa 7
- 3 usos
- 4 riscos
- 5 precauções
- 6 referências
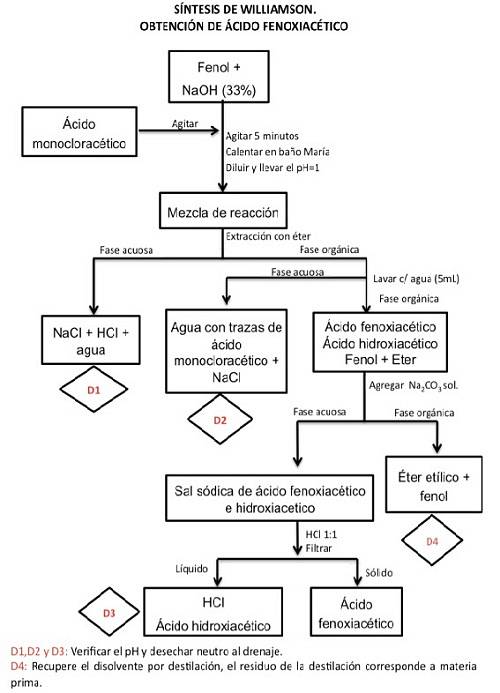
Síntese de ácido fenoxiacético
O fenol é um álcool e, como tal, se comporta como um ácido fraco, por isso perde facilmente o próton ácido (H+) contra um álcali (hidróxido de sódio) para se tornar um alcóxido (fenolato). Este mais tarde, por meio de uma substituição nucleofílica bimolecular, formará o éter.
O alcóxido atua como nucleófilo, ou seja, é capaz de ceder 2 elétrons que ficam livres para outra substância. No caso da reação que nos interessa, é o haleto de alquila (ácido monocloroacético), de forma que se liga fortemente por ligações covalentes com ele, formando uma nova substância que neste caso é o éter..
Durante a reação, ocorre um deslocamento do íon haleto, que é substituído pelo ânion alcóxido. Esta reação é conhecida pelo nome de síntese de éteres de Williamson..
A quantidade de produto obtido e a velocidade com que é produzido dependerão da concentração dos reagentes envolvidos, pois se trata de uma reação cinética de segunda ordem, onde a colisão das moléculas (nucleófilo + haleto de alquila) determina sua eficácia..
Processar
Passo 1
Para iniciar a síntese do ácido fenoxiacético, 0,5 g de fenol é cuidadosamente pesado e colocado em um frasco em formato de pêra com capacidade para 50 ml. 2,5 ml de hidróxido de sódio (NaOH) a 33% (p / v) são adicionados para dissolvê-lo.
Verifique a alcalinidade da solução com um papel indicador de pH. Coloque uma tampa de cortiça no frasco e misture vigorosamente por 5 minutos. Um agitador magnético pode ser usado para misturar.
Passo 2
Em seguida, adicione 0,75 g de ácido monocloroacético e repita o procedimento de mistura por 5 minutos..
Se a mistura procurar endurecer ou ficar pastosa, pode-se adicionar água (entre 1 a 3 ml), mas esta vai sendo acrescentada aos poucos até que volte à textura anterior, sem diluir muito.
etapa 3
Destampe o frasco e coloque-o em banho-maria com sistema de refluxo por 10 minutos. Se o sistema de fluxo não estiver disponível, deixe-o por 40 minutos.
Passo 4
Deixar a solução esfriar e adicionar 5 ml de água, depois acidificar com solução concentrada de HCl até atingir pH 1. (medir o pH com papel para esse fim).
Etapa 5
Passe a mistura cuidadosamente pelo funil de separação e extraia três vezes, utilizando 5 ml de éter etílico em cada procedimento..
Junte os extratos orgânicos e coloque de volta no funil de separação para executar uma lavagem com água em triplicata, usando 5 ml de água para cada lavagem..
As frações aquosas são separadas para serem descartadas.
Etapa 6
Posteriormente, a fração orgânica é extraída com 3 ml de carbonato de sódio (NadoisCO3) a 15% três vezes.
O extrato aquoso alcalino obtido é colocado em banho de gelo e acidificado com HCl até pH = 1, o que gera a precipitação do produto. A etapa de acidificação deve ser realizada com muito cuidado adicionando gota a gota, pois a reação gera espuma e se for adicionada abruptamente pode espirrar.
O sólido é obtido por filtração a vácuo, o precipitado é lavado e deixado secar.
Etapa 7
O produto obtido é pesado e o rendimento e o ponto de fusão são observados..
Formulários
O ácido fenoxiacético sozinho tem uma atividade fungicida contra certos fungos, como Candida albicans e Trichophyton rubrum. Essa ação foi descrita em uma investigação realizada por González et al..
O trabalho revelou que a concentração mínima inibitória ou fungistática (MIC) e a concentração fungicida mínima (CMF) foram iguais (2,5 mg / ml) para 13 espécies de Candida albicans de amostras clínicas, especificamente de pacientes com onicomicose.
Embora uma tensão de Candida albicans ATCC 10231 tinha um MIC de 2,5 mg / ml e um CMF de 5,0 mg / ml. Por sua parte, Trichophyton rubrum apresentou CIM de 0,313 mg / ml e CMF de 1,25 mg / ml em 8 cepas analisadas de unhas infectadas.
Além disso, o ácido fenoxiacético é muito útil como esfoliante da queratina, pois é capaz de minimizar calosidades ou espinhas na pele afetada por essas características..
Por outro lado, o ácido fenoxiacético é uma matéria-prima para a síntese de pesticidas, especificamente herbicidas, como Astix e Duplosan..
Riscos
Se o produto for ingerido acidentalmente, causará irritação das membranas mucosas ao longo do trato gastrointestinal (boca, esôfago, estômago e intestinos)..
Se inalado, causa irritação da mucosa respiratória, causando insuficiência respiratória e tosse..
Na pele pode causar ligeira irritação. Enquanto na mucosa ocular, a irritação será mais severa. Nestes casos, recomenda-se lavar a área afetada com bastante água e sabão e lavar com bastante água na mucosa ocular.
Este produto tem sido associado como fator predisponente para o quadro ou aparecimento de tumores de gordura. Esses tumores costumam se desenvolver nas extremidades ou abdômen.
Por outro lado, este produto é classificado como não perigoso para transporte de acordo com os critérios descritos pelos regulamentos de transporte.
Pesticidas derivados do ácido fenoxiacético são geralmente tóxicos para o meio ambiente e têm sido relacionados a mutações genéticas, especificamente com a translocação t presente no linfoma não Hodgkin em humanos..
Precauções
- Este produto deve ser mantido longe de agentes oxidantes fortes e bases com as quais possa reagir violentamente..
- É importante evitar o aquecimento deste produto.
- Manuseie usando medidas de proteção, como luvas, bata, óculos de segurança.
Referências
- González G, Trujillo R. Ácido fenoxiacético, identificação e determinação de sua ação antifúngica em vitro contra Candida albicans e Trichophyton rubrum. Rev. Peruana da Faculdade de Farmácia, 1998; 34 (109). Disponível em: unmsm.edu
- "Ácido fenoxiacético". Wikipédia, a enciclopédia livre. 13 de maio de 2014, 17:21 UTC. 13 de maio de 2014, 17:21 wikipedia.org
- Merck Laboratories. Ficha de dados de segurança. 2017. Disponível em: ens.uabc.mx/
- Laboratórios Aventis. Folha de dados de segurança da Aventis. 2001. Disponível em: afipa.cl
- Gutiérrez M. Fenoxiacéticos em Emergências Toxicológicas. Centro de Aconselhamento e Informação Toxicológica CIATOX. Universidade nacional da Colômbia. Disponível em: encolombia.com
- Sandoval M. (2015). Manual de Práticas do Laboratório de Química Orgânica II. Faculdade de Química da Universidade Nacional Autônoma do México.
- Merck Laboratories. Ficha de dados de segurança de acordo com o regulamento EC No. 1907/2006. 2015 Disponível em: ens.uabc.mx/
- Berzal-Cantalejo M, Herranz-Torrubiano A, Cuenca-González C. Tumor adiposo com sintomas de alarme. Rev Clín Med Fam 2015, 8 (3): 246-250. Disponível em: scielo.isciii.es/scielo.
- Matheus T, Bolaños A. Micronuclei: biomarcador de genotoxicidade em pessoas expostas a pesticidas. Salus, 2014; 18 (2): 18-26. Disponível em: ve.scielo.org

Ainda sem comentários