
Estrutura, propriedades, produção e usos do ácido cítrico
O ácido cítrico é um composto orgânico que consiste em um ácido fraco cuja fórmula química é C6H8OU7. Como o próprio nome indica, uma de suas principais fontes naturais são as frutas cítricas, e também deriva da palavra latina 'cítrico', que significa amargo..
Não é apenas um ácido fraco, mas também poliprótico; ou seja, ele pode liberar mais de um íon de hidrogênio, H+. É precisamente um ácido tricarboxílico, por isso tem três grupos -COOH que doam íons H+. Cada um deles tem sua própria tendência de se libertar em seu ambiente..

Portanto, sua fórmula estrutural é melhor definida como C3H5O (COOH)3. Essa é a razão química de sua contribuição para o sabor característico de, por exemplo, gomos de laranja. Embora venha das frutas, seus cristais não foram isolados até 1784 de um suco de limão na Inglaterra.
Compõe cerca de 8% em massa de algumas frutas cítricas, como limões e toranjas. Ele também pode ser encontrado em pimentas, tomates, alcachofras e outros alimentos..
Índice do artigo
- 1 Onde o ácido cítrico é encontrado?
- 2 Estrutura do ácido cítrico
- 2.1 Interações intermoleculares
- 3 Propriedades físicas e químicas
- 3.1 Peso molecular
- 3.2 Aparência física
- 3.3 Sabor
- 3.4 Ponto de fusão
- 3.5 Ponto de ebulição
- 3,6 Densidade
- 3.7 Solubilidade
- 3,8 pKa
- 3.9 Decomposição
- 3.10 Derivativos
- 4 Produção
- 4.1 Síntese química ou sintética
- 4.2 Natural
- 4.3 Por fermentação
- 5 usos
- 5.1 Na indústria de alimentos
- 5.2 Na indústria farmacêutica
- 5.3 Na indústria cosmética e em geral
- 6 Toxicidade
- 7 referências
Onde o ácido cítrico é encontrado?
É encontrado em baixas proporções em todas as plantas e animais, e é um metabólito de seres vivos. É um composto intermediário do metabolismo aeróbio presente no ciclo do ácido tricarboxílico ou ciclo do ácido cítrico. Em biologia ou bioquímica, este ciclo também é conhecido como ciclo de Krebs, uma via de metabolismo de anfibólio.
Além de ser naturalmente encontrado em plantas e animais, esse ácido é obtido sinteticamente em grande escala por meio da fermentação..
É amplamente utilizado na indústria alimentícia, farmacêutica e química, e se comporta como conservante natural. Ele e seus derivados são fabricados maciçamente em nível industrial para dar sabor a alimentos sólidos e líquidos.
Encontra uso como aditivo em variedades de produtos de beleza para a pele; também é usado como agente quelante, acidificante e antioxidante. No entanto, seu uso em concentrações altas ou puras não é recomendado; pois pode causar irritação, alergias e até câncer.
Estrutura do ácido cítrico
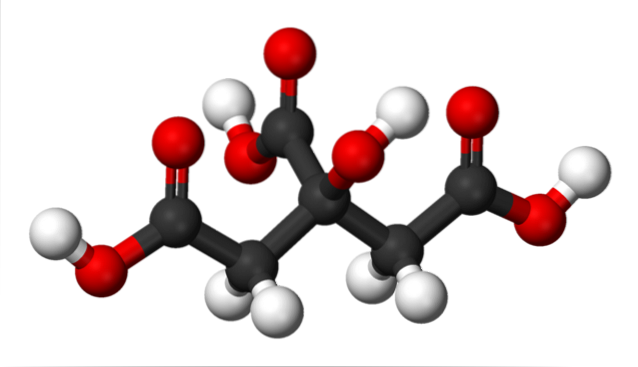
Na imagem superior, a estrutura do ácido cítrico é representada com um modelo de esferas e barras. Se você olhar de perto, você encontrará o esqueleto de apenas três carbonos: propano.
O átomo de carbono no centro está ligado a um grupo -OH, que na presença de grupos carboxila, -COOH, adota a terminologia 'hidroxi'. Os três grupos -COOH são facilmente reconhecíveis nas extremidades esquerda e direita e no topo da estrutura; É a partir deles que o H é liberado+.
Por outro lado, o grupo -OH também é capaz de perder um próton ácido, então no total não haveria três H+, mas quatro. No entanto, este último requer uma base consideravelmente forte e, conseqüentemente, sua contribuição para a acidez característica do ácido cítrico é muito menor em comparação com a dos grupos -COOH..
Do exposto, segue-se que o ácido cítrico também pode ser chamado de: 2-hidroxi-1,2,3-tricarboxílico propano.
Há um grupo -OH em C-2, que é adjacente ao grupo -COOH (observe o centro superior da estrutura). Por causa disso, o ácido cítrico também se enquadra na classificação de alfa-hidroxiácidos; onde alfa significa 'adjacente', isto é, há apenas um átomo de carbono separando o -COOH e -OH.
Interações intermoleculares
Como pode ser visto, a estrutura do ácido cítrico tem alta capacidade de doar e aceitar ligações de hidrogênio. Isso o torna muito relacionado à água, e também a razão pela qual ele forma um sólido monohidratado, cristais romboédricos, com muita facilidade..
Essas ligações de hidrogênio também são responsáveis por erguer os cristais monoclínicos incolores de ácido cítrico. Cristais anidros (sem água) podem ser obtidos após formação em água quente, seguida de evaporação completa..
Propriedades físicas e químicas
Peso molecular
210,14 g / mol.
Aparência física
Cristais de ácido incolores e inodoros.
Gosto
Azedo e amargo.
Ponto de fusão
153 ° C.
Ponto de ebulição
175 ° C.
Densidade
1,66 g / mL.
Solubilidade
É um composto altamente solúvel em água. Também é muito solúvel em outros solventes polares, como etanol e acetato de etila. Em solventes apolares e aromáticos, como benzeno, tolueno, clorofórmio e xileno, é insolúvel.
pKa
-3,1
-4,7
-6,4
Estes são os valores de pKa para cada um dos três grupos -COOH. Observe que o terceiro pKa (6,4) é apenas ligeiramente ácido, por isso se dissocia pouco.
Decomposição
Em temperaturas extremas ou acima de 175 ° C, ele se decompõe liberando COdois e água. Portanto, o líquido não atinge uma fervura significativa, pois se decompõe primeiro..
Derivados
Conforme você perde H+, outros cátions tomam seu lugar, mas de forma iônica; ou seja, as cargas negativas dos grupos -COO- atrair outras espécies de cargas positivas, como Na+. Quanto mais desprotonado o ácido cítrico, mais cátions seus derivados chamados citratos terão.
Um exemplo é o citrato de sódio, que tem um efeito quelante muito útil como coagulante. Esses citratos podem, portanto, formar complexos com metais em solução..
Por outro lado, o H+ dos grupos -COOH podem até ser substituídos por outras espécies ligadas covalentemente, como cadeias laterais R, dando origem a ésteres de citrato: C3H5OU (COOR)3.
A diversidade é muito grande, uma vez que nem todo H deve ser necessariamente substituído por R, mas também por cátions.
Produção
O ácido cítrico pode ser produzido natural e comercialmente obtido pela fermentação de carboidratos. Sua produção também tem sido feita de forma sintética por meio de processos químicos que hoje não são muito atualizados..
Diversos processos biotecnológicos têm sido utilizados para sua produção, uma vez que este composto é muito procurado em todo o mundo..
Síntese química ou sintética
-Um desses processos de síntese química é realizado sob condições de alta pressão a partir de sais de cálcio de isocitrato. O suco extraído das frutas cítricas é tratado com hidróxido de cálcio, obtendo-se o citrato de cálcio..
Esse sal é então extraído e feito reagir com uma solução diluída de ácido sulfúrico, cuja função é protonar o citrato à sua forma ácida original..
-O ácido cítrico também foi sintetizado a partir da glicerina, substituindo seus componentes por um grupo carboxila. Como acabamos de mencionar, esses processos não são ideais para a produção de ácido cítrico em grande escala..
natural
No corpo, o ácido cítrico ocorre naturalmente no metabolismo aeróbio: o ciclo do ácido tricarboxílico. Quando a acetil coenzima A (acetil-CoA) entra no ciclo, ela se liga ao ácido oxaloacético, formando ácido cítrico..
E de onde vem o acetil-CoA?
Nas reações de catabolismo de ácidos graxos, carboidratos, entre outros substratos, na presença de Odois acetil-CoA é produzido. É formado como produto da beta-oxidação dos ácidos graxos, da transformação do piruvato gerado na glicólise..
O ácido cítrico formado no ciclo de Krebs ou ciclo do ácido cítrico será oxidado em ácido alfa-cetoglutárico. Este processo representa uma via anfibólica de redução da oxidação, a partir da qual são gerados equivalentes que irão produzir energia ou ATP..
No entanto, a produção comercial de ácido cítrico como um intermediário do metabolismo aeróbio também não tem sido lucrativa ou satisfatória. Somente em condições de desequilíbrio orgânico é que a concentração desse metabólito pode ser aumentada, o que não é viável para microrganismos.
Por fermentação
Microorganismos, como fungos e bactérias, produzem ácido cítrico fermentando açúcares.
A produção de ácido cítrico a partir da fermentação microbiana tem apresentado melhores resultados do que a obtenção por síntese química. Linhas de pesquisa têm sido desenvolvidas relacionadas a este método de produção comercial em massa, que oferece grandes vantagens econômicas..
As técnicas de cultivo em nível industrial variaram ao longo do tempo. Culturas para fermentação de superfície e submersa têm sido utilizadas. Culturas submersas são aquelas em que os microrganismos produzem fermentação a partir de substratos contidos em meio líquido.
Os processos de produção de ácido cítrico por fermentação submersa, que ocorre em condições anaeróbias, têm sido ótimos..
Alguns cogumelos gostam Aspergillus niger, Saccahromicopsis sp, e bactérias gostam Bacillus licheniformis, têm permitido obter um alto rendimento com este tipo de fermentação.
Cogumelos como Aspergillus niger ou candida sp, Eles produzem ácido cítrico como resultado da fermentação do melaço e do amido. Açúcar de cana, milho e beterraba, entre outros, também são usados como substratos de fermentação..
Formulários
O ácido cítrico é amplamente utilizado na indústria alimentícia, na fabricação de produtos farmacêuticos. Também é utilizado em inúmeros processos químicos e biotecnológicos..
Na industria alimentícia
-O ácido cítrico é utilizado principalmente na indústria alimentícia, pois confere um agradável sabor ácido. É muito solúvel em água, por isso é adicionado em bebidas, doces, balas, geléias e frutas congeladas. Também é utilizado na preparação de vinhos, cervejas, entre outras bebidas..
-Além de adicionar um sabor ácido, inativa os oligoelementos conferindo proteção ao ácido ascórbico ou à vitamina C. Também atua como emulsificante em sorvetes e queijos. Contribui para a inativação de enzimas oxidativas, diminuindo o pH dos alimentos.
-Aumenta a eficácia dos conservantes adicionados aos alimentos. Ao fornecer um pH relativamente baixo, diminui a probabilidade de os microorganismos sobreviverem em alimentos processados, aumentando assim sua vida útil..
-Em gorduras e óleos, o ácido cítrico é usado para reforçar o efeito antioxidante sinérgico (de todos os componentes gordurosos) que esse tipo de nutriente pode ter..
Na industria farmacêutica
-O ácido cítrico também é amplamente utilizado como excipiente na indústria farmacêutica para melhorar o sabor e a dissolução de medicamentos..
-Em combinação com o bicarbonato, o ácido cítrico é adicionado a produtos em pó e comprimidos de forma a atuar como um produto efervescente.
-Os sais do ácido cítrico permitem seu uso como anticoagulante, pois tem a capacidade de quelar o cálcio. O ácido cítrico é administrado em suplementos minerais, como sais de citrato.
-Ao acidificar o meio do processo de absorção no nível intestinal, o ácido cítrico otimiza a captação de vitaminas e de alguns medicamentos. Sua forma anidra é administrada como coadjuvante de outras drogas na dissolução de cálculos..
-É também utilizado como acidificante, adstringente, como agente que facilita a dissolução dos princípios ativos de diversos produtos farmacêuticos..
Na indústria cosmética e em geral
-O ácido cítrico é usado como agente quelante para íons metálicos em produtos de higiene pessoal e cosméticos..
-É utilizado para limpar e polir metais em geral, retirando o óxido que os recobre..
-Em baixas concentrações serve como aditivo em produtos de limpeza ecológicos, que são benignos para o meio ambiente e a natureza..
-Tem uma grande variedade de utilizações: é utilizado em reagentes fotográficos, têxteis, no curtimento de couro.
-Adiciona tintas de impressão.
Toxicidade
Relatos de sua toxicidade estão associados a alta concentração de ácido cítrico, tempo de exposição, impurezas, entre outros fatores..
As soluções de ácido cítrico diluídas não representam nenhum risco ou perigo para a saúde. No entanto, o ácido cítrico puro ou concentrado representa um risco à segurança e, portanto, não deve ser consumido..
Puro ou concentrado, é corrosivo e irritante em contato com a pele e as mucosas dos olhos, nariz e garganta. Pode causar reações alérgicas na pele e toxicidade aguda se ingerido..
A inalação de pó de ácido cítrico puro também pode afetar a mucosa do trato respiratório. A inalação pode causar falta de ar, alergias, sensibilização da mucosa respiratória e pode até desencadear asma.
Efeitos tóxicos reprodutivos são relatados. O ácido cítrico pode causar defeitos genéticos, causando mutação nas células germinativas.
E, finalmente, é considerado perigoso ou tóxico para o habitat aquático e, em geral, o ácido cítrico concentrado é corrosivo para os metais..
Referências
- BellChem (21 de abril de 2015). Os usos do ácido cítrico na indústria de alimentos. Recuperado de: bellchem.com
- Vandenberghe, Luciana P. S, Soccol, Carlos R, Pandey, Ashok e Lebeault, Jean-Michel. (1999). Produção microbiana de ácido cítrico. Arquivos Brasileiros de Biologia e Tecnologia, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Ácido Cítrico. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Ácido Cítrico. Recuperado de: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. e Stanley, G. (2008). Química. (8ava. ed). CENGAGE Learning: México.
- Berovic, M. e Legisa, M. (2007). Produção de ácido cítrico. Revisão anual da biotecnologia. Recuperado de: researchgate.net



Ainda sem comentários