
Estrutura, propriedades, formação do ácido bromídrico (HBr)

O ácido bromídrico É um composto inorgânico resultante da dissolução aquosa de um gás denominado brometo de hidrogênio. Sua fórmula química é o HBr, podendo ser considerado de diferentes maneiras equivalentes: como um hidreto molecular, ou haleto de hidrogênio em água; isto é, um hidrácido.
Nas equações químicas deve ser escrito como HBr (ac), indicando que é o ácido bromídrico e não o gás. Este ácido é um dos mais fortes conhecidos, ainda mais do que o ácido clorídrico, o HCl. A explicação para isso está na natureza de sua ligação covalente.
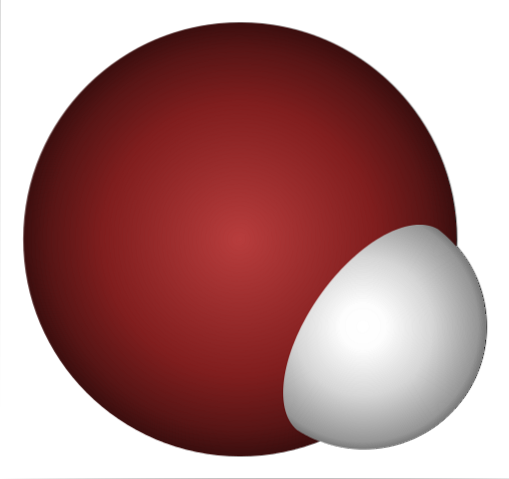
Por que o HBr é um ácido tão forte e ainda mais dissolvido em água? Como a ligação covalente H-Br é muito fraca, devido à fraca sobreposição dos orbitais 1s de H e 4p de Br.
Isso não é surpreendente se você olhar atentamente para a imagem acima, onde claramente o átomo de bromo (marrom) é muito maior do que o átomo de hidrogênio (branco).
Consequentemente, qualquer perturbação faz com que a ligação H-Br se quebre, liberando o íon H+. Portanto, o ácido bromídrico é um ácido de Brönsted, pois transfere prótons ou íons de hidrogênio. Sua força é tal que é usado na síntese de vários compostos organobrominados (como 1-Bromo etano, CH3CHdoisBr).
O ácido bromídrico é, depois do hidroiódico, HI, um dos hidrácidos mais fortes e úteis para a digestão de certas amostras sólidas.
Índice do artigo
- 1 Estrutura do ácido bromídrico
- 1.1 Acidez
- 2 Propriedades físicas e químicas
- 2.1 Fórmula molecular
- 2.2 Peso molecular
- 2.3 Aparência física
- 2.4 Odor
- 2.5 Limite de odor
- 2.6 Densidade
- 2.7 Ponto de fusão
- 2.8 Ponto de ebulição
- 2.9 Solubilidade em água
- 2,10 Densidade de vapor
- 2.11 Acidez pKa
- 2,12 capacidade calórica
- 2.13 Entalpia molar padrão
- 2.14 Entropia molar padrão
- 2,15 ponto de fulgor
- 3 Nomenclatura
- 4 Como é formado?
- 4.1 Mistura de hidrogênio e bromo em água
- 4.2 Tribrometo de fósforo
- 4.3 Dióxido de enxofre e bromo
- 5 usos
- 5.1 Preparação de brometos
- 5.2 Síntese de haletos de alquila
- 5.3 Catalisador
- 6 referências
Estrutura do ácido bromídrico
A imagem mostra a estrutura do H-Br, cujas propriedades e características, mesmo que sejam gasosas, estão intimamente relacionadas às suas soluções aquosas. É por isso que chega um ponto em que há confusão sobre qual dos dois compostos é referido: HBr ou HBr (ac).
A estrutura do HBr (ac) é diferente da do HBr, pois agora as moléculas de água estão resolvendo essa molécula diatômica. Quando está perto o suficiente, o H é transferido+ a uma molécula de HdoisOu conforme indicado na seguinte equação química:
HBr + HdoisO => Br-- + H3OU+
Assim, a estrutura do ácido bromídrico consiste em íons Br-- e H3OU+ interagindo eletrostaticamente. Agora, é um pouco diferente da ligação covalente de H-Br.
A sua elevada acidez deve-se ao volumoso anião Br.- mal consegue interagir com o H3OU+, incapaz de impedi-lo de transferir o H+ para outra espécie química circundante.
Acidez
Por exemplo, Cl- e o F- embora eles não formem ligações covalentes com H3OU+, eles podem interagir por meio de outras forças intermoleculares, como ligações de hidrogênio (que apenas F- é capaz de aceitá-los). Ligações de hidrogênio F--H-OHdois+ "Impedir" a doação do H+.
É por esta razão que o ácido fluorídrico, HF, é um ácido mais fraco. na água do que o ácido bromídrico; uma vez que, as interações iônicas Br- H3OU+ não incomoda a transferência do H+.
No entanto, embora a água esteja presente no HBr (aq), seu comportamento é basicamente semelhante ao de uma molécula de H-Br; isto é, um H+ é transferido de HBr ou Br-H3OU+.
Propriedades físicas e químicas
Fórmula molecular
HBr.
Peso molecular
80,972 g / mol. Observe que, conforme mencionado na seção anterior, apenas o HBr é considerado e não a molécula de água. Se o peso molecular fosse retirado da fórmula Br-H3OU+ teria um valor de aproximadamente 99 g / mol.
Aparência física
Líquido incolor ou amarelo claro, que dependerá da concentração de HBr dissolvido. Quanto mais amarelo for, mais concentrado e perigoso será.
Odor
Pungente, irritante.
Limiar de odor
6,67 mg / m3.
Densidade
1,49 g / cm3 (Solução aquosa a 48% p / p). Este valor, assim como os correspondentes aos pontos de fusão e ebulição, dependem da quantidade de HBr dissolvido na água..
Ponto de fusão
-11 ° C (12 ° F, 393 ° K) (solução aquosa de 49% p / p).
Ponto de ebulição
122 ºC (252 ºF. 393 ºK) a 700 mmHg (solução aquosa 47-49% p / p).
Solubilidade em água
-221 g / 100 ml (a 0 ° C).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Estes valores referem-se ao HBr gasoso, não ao ácido bromídrico. Como pode ser visto, à medida que a temperatura aumenta, a solubilidade do HBr diminui; comportamento natural dos gases. Conseqüentemente, se soluções concentradas de HBr (aq) forem necessárias, é melhor trabalhar com elas em baixas temperaturas..
Se trabalhar em altas temperaturas, o HBr escapará na forma de moléculas diatômicas gasosas, portanto o reator deve ser vedado para evitar seu vazamento.
Densidade do vapor
2,71 (em relação ao ar = 1).
Acidez pKa
-9,0. Esta constante negativa é indicativa de sua grande força de acidez..
Capacidade calórica
29,1 kJ / mol.
Entalpia molar padrão
198,7 kJ / mol (298 ºK).
Entropia molar padrão
-36,3 kJ / mol.
ponto de ignição
Não inflamável.
Nomenclatura
Seu nome 'ácido bromídrico' combina dois fatos: a presença de água, e que o bromo tem uma valência de -1 no composto. Em inglês é um pouco mais óbvio: ácido bromídrico, onde o prefixo 'hidro' (ou hidro) se refere à água; embora, na verdade, também possa se referir a hidrogênio.
O bromo tem valência -1 porque está ligado a um átomo de hidrogênio menos eletronegativo do que ele; mas se estiver ligado ou interagindo com átomos de oxigênio, pode ter numerosas valências, como: +2, +3, +5 e +7. Com o H ele só pode adotar uma única valência, e é por isso que o sufixo -ico é adicionado ao seu nome.
Enquanto HBr (g), brometo de hidrogênio, é anidro; ou seja, não tem água. Portanto, é denominado em outros padrões de nomenclatura, correspondendo ao dos halogenetos de hidrogênio..
Como se forma?
Existem vários métodos sintéticos para a preparação de ácido bromídrico. Alguns deles são:
Mistura de hidrogênio e bromo em água
Sem descrever os detalhes técnicos, esse ácido pode ser obtido a partir da mistura direta de hidrogênio e bromo em um reator cheio de água..
Hdois + Brdois => HBr
Desse modo, à medida que o HBr se forma, ele se dissolve na água; isso pode arrastá-lo para as destilações, de modo que soluções com diferentes concentrações podem ser extraídas. O hidrogênio é um gás e o bromo é um líquido avermelhado escuro.
Tribrometo de fósforo
Em um processo mais elaborado, areia, fósforo vermelho hidratado e bromo são misturados. Os coletores de água são colocados em banhos de gelo para evitar que o HBr escape e forme ácido bromídrico. As reações são:
2P + 3Brdois => 2PBr3
PBr3 + 3HdoisO => 3HBr + H3PO3
Dióxido de enxofre e bromo
Outra forma de prepará-lo é reagir o bromo com dióxido de enxofre na água:
Brdois + SWdois + 2hdoisO => 2HBr + HdoisSW4
Esta é uma reação redox. O BRdois reduz, ganha elétrons, ligando-se aos hidrogênios; enquanto o SOdois oxida, perde elétrons, quando forma ligações mais covalentes com outros oxigênios, como no ácido sulfúrico.
Formulários
Preparação de brometo
Os sais de brometo podem ser preparados fazendo reagir HBr (aq) com um hidróxido de metal. Por exemplo, a produção de brometo de cálcio é considerada:
Ca (OH)dois + 2HBr => CaBrdois + HdoisOU
Outro exemplo é para o brometo de sódio:
NaOH + HBr => NaBr + HdoisOU
Assim, muitos dos brometos inorgânicos podem ser preparados.
Síntese de haletos de alquila
E os brometos orgânicos? Estes são compostos organobrominados: RBr ou ArBr.
Desidratação de álcool
A matéria-prima para obtê-los pode ser o álcool. Quando são protonados pela acidez do HBr, eles formam água, que é um bom grupo de saída, e em seu lugar é incorporado o volumoso átomo de Br, que se tornará covalentemente ligado ao carbono:
ROH + HBr => RBr + HdoisOU
Essa desidratação é realizada em temperaturas acima de 100 ° C, com o objetivo de facilitar a quebra da ligação R-OH.dois+.
Adição a alcenos e alcinos
A molécula de HBr pode ser adicionada de sua solução aquosa à ligação dupla ou tripla de um alceno ou alcino:
RdoisC = CRdois + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Vários produtos podem ser obtidos, mas em condições simples, o produto é formado principalmente onde o bromo está ligado a um carbono secundário, terciário ou quaternário (regra de Markovnikov).
Esses halogenetos estão envolvidos na síntese de outros compostos orgânicos e sua gama de usos é muito extensa. Da mesma forma, alguns deles podem até ser usados na síntese ou desenho de novos medicamentos..
Clivagem de éter
A partir dos éteres, dois halogenetos de alquila podem ser obtidos simultaneamente, cada um carregando uma das duas cadeias laterais R ou R 'do éter inicial R-O-R'. Acontece algo parecido com a desidratação dos álcoois, mas seu mecanismo de reação é diferente.
A reação pode ser delineada com a seguinte equação química:
ROR '+ 2HBr => RBr + R'Br
E a água também é liberada.
Catalisador
Sua acidez é tal que pode ser usado como um catalisador ácido eficaz. Em vez de adicionar o ânion Br- à estrutura molecular, abre caminho para outra molécula fazer isso.
Referências
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10º edição.). Wiley plus.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Steven A. Hardinger. (2017). Glossário Ilustrado de Química Orgânica: Ácido bromídrico. Recuperado de: chem.ucla.edu
- Wikipedia. (2018). Ácido bromídrico. Recuperado de: en.wikipedia.org
- PubChem. (2018). Ácido bromídrico. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Instituto Nacional de Segurança e Higiene no Trabalho. (2011). Brometo de hidrogênio. [PDF]. Recuperado de: insht.es
- PrepChem. (2016). Preparação de ácido bromídrico. Recuperado de: prepchem.com



Ainda sem comentários