
Conceito de carga nuclear efetiva, como calculá-la e exemplos
O carga nuclear efetiva (Zef) é a força atrativa exercida pelo núcleo sobre qualquer um dos elétrons após ser reduzida pelos efeitos de blindagem e penetração. Se não houvesse tais efeitos, os elétrons sentiriam a força atrativa da carga nuclear real Z.
Na imagem abaixo temos o modelo atômico de Bohr para um átomo fictício. Seu núcleo tem uma carga nuclear Z = + n, que atrai os elétrons que orbitam ao seu redor (os círculos azuis). Pode-se observar que dois elétrons estão em uma órbita mais próxima do núcleo, enquanto o terceiro elétron está a uma distância maior dele..
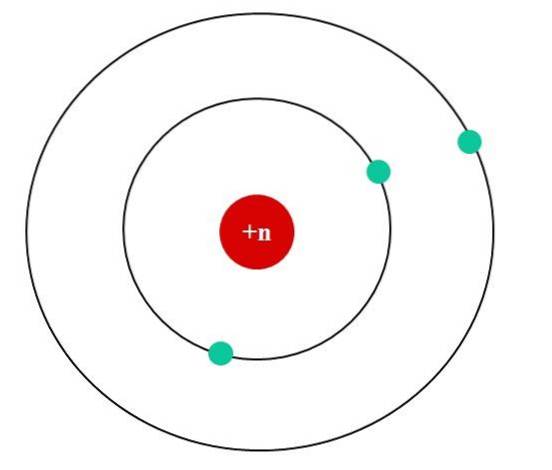
O terceiro elétron orbita sentindo as repulsões eletrostáticas dos outros dois elétrons, de modo que o núcleo o atrai com menos força; isto é, a interação elétron-núcleo diminui como resultado da blindagem dos primeiros dois elétrons.
Assim, os primeiros dois elétrons sentem a força atrativa de a + n carga, mas o terceiro experimenta uma carga nuclear efetiva de + (n-2)..
Porém, dito Zef só seria válido se as distâncias (o raio) ao núcleo de todos os elétrons fossem sempre constantes e definidas, localizando suas cargas negativas (-1).
Índice do artigo
- 1 conceito
- 1.1 Efeitos de penetração e proteção
- 2 Como calcular?
- 2.1 Regra de Slater
- 3 exemplos
- 3.1 Determine Zef para elétrons no orbital 2s2 em berílio
- 3.2 Determine Zef para os elétrons no orbital 3p3 do fósforo
- 4 referências
Conceito
Os prótons definem os núcleos dos elementos químicos e os elétrons definem sua identidade dentro de um conjunto de características (os grupos da tabela periódica)..
Os prótons aumentam a carga nuclear Z à taxa de n + 1, que é compensada pela adição de um novo elétron para estabilizar o átomo.
À medida que o número de prótons aumenta, o núcleo é "coberto" por uma nuvem dinâmica de elétrons, na qual as regiões pelas quais eles circulam são definidas pelas distribuições de probabilidade das partes radiais e angulares das funções de onda (os orbitais).
A partir dessa abordagem, os elétrons não orbitam em uma região definida do espaço ao redor do núcleo, mas, em vez disso, como as lâminas de um leque em rotação rápida, eles se borram nas formas dos orbitais conhecidos s, p, d e f.
Por este motivo, a carga negativa -1 de um elétron é distribuída pelas regiões que os orbitais penetram; quanto maior o efeito de penetração, maior será a carga nuclear efetiva que o referido elétron experimentará no orbital.
Efeitos de penetração e proteção
De acordo com a explicação acima, os elétrons nas camadas internas não contribuem com uma carga -1 para a repulsão estabilizadora dos elétrons nas camadas externas..
No entanto, esse kernel (as camadas previamente preenchidas por elétrons) serve como uma "parede" que impede a força atrativa do núcleo de atingir os elétrons externos..
Isso é conhecido como efeito de tela ou efeito de proteção. Além disso, nem todos os elétrons nas camadas externas experimentam a mesma magnitude desse efeito; por exemplo, se você ocupa um orbital que tem um caráter altamente penetrante (isto é, que transita muito perto do núcleo e outros orbitais), então você sentirá um Zef superior.
Como resultado, uma ordem de estabilidade energética surge como uma função desses Zef para os orbitais: s Isso significa que o orbital 2p tem maior energia (menos estabilizada pela carga do núcleo) do que o orbital 2s.. Quanto mais pobre for o efeito de penetração exercido pelo orbital, menor será seu efeito de proteção sobre o resto dos elétrons externos. Os orbitais d e f mostram muitos buracos (nós) onde o núcleo atrai outros elétrons. Supondo que as cargas negativas sejam localizadas, a fórmula para calcular Zef para qualquer elétron é: Zef = Z - σ Nesta fórmula, σ é a constante de blindagem determinada pelos elétrons do kernel. Isso ocorre porque, teoricamente, os elétrons mais externos não contribuem para a blindagem dos elétrons internos. Em outras palavras, 1sdois escudo elétron 2s1, mas 2s1 não protege os elétrons Z 1sdois. Se Z = 40, desprezando os efeitos mencionados, o último elétron experimentará uma Zef igual a 1 (40-39). A regra de Slater é uma boa aproximação dos valores de Zef para os elétrons no átomo. Para aplicá-lo, siga as etapas abaixo: 1- A configuração eletrônica do átomo (ou íon) deve ser escrita da seguinte forma: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) ... 2- Os elétrons que estão à direita daquele que está sendo considerado não contribuem para o efeito de blindagem. 3- Os elétrons que estão dentro do mesmo grupo (marcados entre parênteses) fornecem 0,35 a carga do elétron a menos que seja o grupo 1s, sendo 0,30 em vez. 4- Se o elétron ocupa um orbital s ou p, então todos os orbitais n-1 contribuem com 0,85, e todos os orbitais n-2 uma unidade. 5- Caso o elétron ocupe um orbital d ou f, todos aqueles à sua esquerda contribuem com uma unidade. Seguindo o modo de representação de Slater, a configuração eletrônica do Be (Z = 4) é: (1sdois) (2sdois2 P0) Como há dois elétrons no orbital, um deles contribui para a blindagem do outro, e o orbital 1s é o n-1 do orbital 2s. Então, desenvolvendo a soma algébrica, temos o seguinte: (0,35) (1) + (0,85) (2) = 2,05 O 0,35 veio do elétron 2s e o 0,85 dos dois elétrons 1s. Agora, aplicando a fórmula de Zef: Zef = 4 - 2,05 = 1,95 O que significa isto? Isso significa que os elétrons no orbital 2sdois experimentam uma carga de +1,95 que os atrai em direção ao núcleo, em vez da carga +4 real. Novamente, continua como no exemplo anterior: (1sdois) (2sdois2 P6) (3sdois3p3) Agora, a soma algébrica é desenvolvida para determinar σ: (, 35) (4) + (0,85) (8) + (1) (2) = 10,2 Então, Zef é a diferença entre σ e Z: Zef = 15-10,2 = 4,8 Em conclusão, os últimos 3p elétrons3 eles experimentam uma carga três vezes menor do que a real. Também deve ser notado que, de acordo com esta regra, os elétrons 3sdois experimentar o mesmo Zef, um resultado que pode levantar dúvidas sobre isso. No entanto, existem modificações na regra de Slater que ajudam a aproximar os valores calculados dos reais..Como calcular?
Regra de Slater
Exemplos
Determine Zef para os elétrons no orbital 2sdois em berílio
Determine Zef para os elétrons no orbital 3p3 de fósforo
Referências



Ainda sem comentários