
Camada de Valência em que consiste, exemplos
O valencia cape É aquele cujos elétrons são responsáveis pelas propriedades químicas de um elemento. Os elétrons nesta camada interagem com os de um átomo vizinho, formando ligações covalentes (A-B); e se eles migram de um átomo para outro mais eletronegativo, ligações iônicas (A + B-).
Esta camada é definida pelo número quântico principal n, que por sua vez indica o período em que o elemento está na tabela periódica. Enquanto a ordem do grupo depende do número de elétrons orbitando na camada de valência. Então, por um n igual a 2, pode ocupar oito elétrons: oito grupos (1-8).
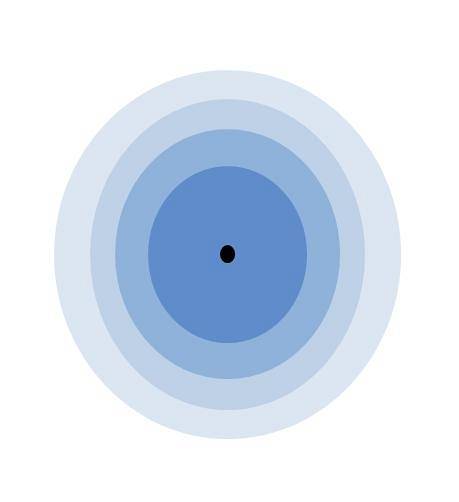
A imagem acima ilustra o significado da camada de valência. O ponto preto no centro do átomo é o núcleo, enquanto os círculos concêntricos restantes são as conchas eletrônicas definidas por n.
Quantas camadas esse átomo tem? Cada um deles tem sua própria cor e, uma vez que são quatro, o átomo tem quatro camadas (n= 4). Observe também que a cor se degrada à medida que a distância da camada ao núcleo aumenta. A camada de valência é a que está mais longe do núcleo: aquela com a cor mais clara.
Índice do artigo
- 1 Qual é a camada de valência?
- 2 recursos
- 3 exemplos
- 3.1 Exemplo 1
- 3.2 Exemplo 2
- 4 referências
Qual é a camada de valência?
De acordo com a imagem, a camada de valência nada mais é do que os últimos orbitais de um átomo ocupado por elétrons. Na capa azul clara, para n= 4, há uma série de orbitais 4s, 4p, 4d e 4f; ou seja, dentro existem outras subcamadas com diferentes recursos eletrônicos.
Um átomo precisa de elétrons para preencher todos os orbitais 4n. Este processo pode ser observado nas configurações eletrônicas dos elementos ao longo de um período.
Por exemplo, o potássio tem uma configuração de elétrons [Ar] 4s1, enquanto o cálcio, à sua direita, [Ar] 4sdois. De acordo com essas configurações, o que é a camada de valência? O termo [Ar] refere-se à configuração eletrônica do gás nobre argônio 1sdois2sdois2 P63sdois3p6. Isso representa a camada interna ou fechada (também conhecida como núcleo).
Como o orbital 4s é aquele com a energia mais alta e no qual os novos elétrons entram, ele representa a camada de valência para K e Ca. Se os átomos de K e Ca fossem comparados com o da imagem, [Ar] todas as camadas internas são coloridas de azul; e 4s a camada azul clara, a camada externa.
Caracteristicas
De tudo o que foi dito acima, algumas características da camada de valência para todos os átomos podem ser resumidas:
-Seu nível de energia é mais alto; o que é o mesmo, é mais removido do núcleo e tem a densidade de elétrons mais baixa (em comparação com outras camadas).
-Está incompleto. Portanto, ele continuará a se encher de elétrons à medida que um período é percorrido da esquerda para a direita na tabela periódica..
-Intervém na formação de ligações covalentes ou iônicas.
No caso dos metais potássio e cálcio, eles são oxidados para se tornarem cátions. O K+ possui configuração eletrônica [Ar], devido à perda de seu único elétron externo 4s1. E do lado de Cadois+, sua configuração também é [Ar]; porque em vez de perder um elétron, você perde dois (4sdois).
Mas qual é a diferença entre o K+ e o Cadois+, se ambos perdessem os elétrons de sua camada de valência e tivessem configuração eletrônica [Ar]? A diferença está em seus raios iônicos. ACdois+ é menor que K+, porque o átomo de cálcio tem um próton adicional que atrai elétrons externos com maior força (cascas fechadas ou de valência).
A camada de valência 4s não desapareceu: ela só está vazia para esses íons.
Exemplos
O conceito de concha de valência pode ser encontrado direta ou indiretamente em muitos aspectos da química. Como seus elétrons são aqueles que participam da formação das ligações, qualquer tópico que os trate (TEV, RPECV, mecanismos de reação, etc.) deve referir-se a essa camada..
Isso ocorre porque, mais importantes do que a camada de valência, são seus elétrons; chamados elétrons de valência. Quando representadas na construção progressiva de configurações eletrônicas, estas definem a estrutura eletrônica do átomo e, portanto, suas propriedades químicas..
A partir dessas informações de um átomo A e outro B, as estruturas de seus compostos podem ser delineadas por meio das estruturas de Lewis. Da mesma forma, as estruturas eletrônicas e moleculares de uma variedade de compostos podem ser determinadas graças ao número de elétrons de valência..
Os exemplos mais simples e possíveis de camadas de valência são encontrados na tabela periódica; especificamente, em configurações de elétrons.
Exemplo 1
É possível identificar um elemento e sua localização na tabela periódica apenas com a configuração eletrônica. Assim, se um elemento X tem configuração [Kr] 5sdois5 p1, O que é e a que período e grupo pertence?
Dado que n= 5, X está no quinto período. Além disso, possui três elétrons de valência: dois no orbital 5sdois e um no 5p1. A camada interna [Kr] não fornece mais informações.
Como X tem três elétrons e seus orbitais 5p estão incompletos, ele está no bloco p; além disso, no grupo IIIA (sistema românico) ou 13 (sistema de numeração atual e aprovado pela IUPAC). X é então o elemento indiano, em.
Exemplo 2
Qual é o elemento X com configuração eletrônica [Kr] 4d105s1? Observe que, como em In, ele pertence ao período 5, uma vez que o orbital 5s1 é aquele com a maior energia. No entanto, a camada de valência também inclui os orbitais 4d, uma vez que eles são incompleto.
As camadas de valência podem então ser designadas como nsnp, para um elemento do bloco p ou s; ou (n-1) dns, para um elemento do bloco d. Portanto, o misterioso elemento X pertence ao bloco d porque sua configuração eletrônica é do tipo (n-1) dns (4d105s1).
A qual grupo você pertence? Adicionando os dez elétrons do orbital 4d10, e um de 5s1, X tem onze elétrons de valência. Portanto, ele deve ser colocado no grupo IB ou 11. Em seguida, movendo-se através do período 5 da tabela periódica para o grupo 11, depara-se com o elemento prata, Ag.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição, p. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 287.
- Centro de Recursos NDT. (s.f.). The Valence Shell. Retirado de: nde-ed.org
- Clackamas Community College. (2002). Elétrons de valência. Recuperado de: dl.clackamas.edu
- Chemistry LibreTexts. (s.f.). Valência e elétrons do núcleo. Recuperado de: chem.libretexts.org



Ainda sem comentários