
Características do átomo de carbono, estrutura, hibridização

O átomo de carbono é talvez o mais importante e emblemático de todos os elementos, porque graças a ele é possível a existência de vida. Envolve em si não apenas alguns elétrons, ou um núcleo com prótons e nêutrons, mas também poeira estelar, que acaba incorporada e forma seres vivos.
Da mesma forma, os átomos de carbono são encontrados na crosta terrestre, embora não em abundância comparável a elementos metálicos como ferro, carbonatos, dióxido de carbono, óleo, diamantes, carboidratos, etc., eles fazem parte de suas manifestações físicas e químicas.
Mas como é o átomo de carbono? Um primeiro esboço impreciso é aquele visto na imagem acima, cujas características são descritas na seção seguinte.
Os átomos de carbono percorrem a atmosfera, os mares, o subsolo, as plantas e qualquer espécie animal. Sua grande diversidade química se deve à alta estabilidade de suas ligações e à forma como estão dispostas no espaço. Assim, por um lado, há grafite suave e lubrificante; e de outro, o diamante, cuja dureza supera a de muitos materiais.
Se o átomo de carbono não tivesse as qualidades que o caracterizam, a química orgânica não existiria completamente. Alguns visionários veem nele os novos materiais do futuro, através do desenho e funcionalização de suas estruturas alotrópicas (nanotubos de carbono, grafeno, fulerenos, etc.).
Índice do artigo
- 1 Características do átomo de carbono
- 2 Estrutura
- 3 Hibridização
- 3,1 sp3
- 3,2 sp2 e sp
- 4 Classificação
- 4.1 Primário
- 4.2 Secundário
- 4.3 Terciário
- 4,4 quaternário
- 5 usos
- 5.1 Unidade de massa atômica
- 5.2 Ciclo e vida do carbono
- 5,3 espectroscopia de 13C NMR
- 6 referências
Características do átomo de carbono
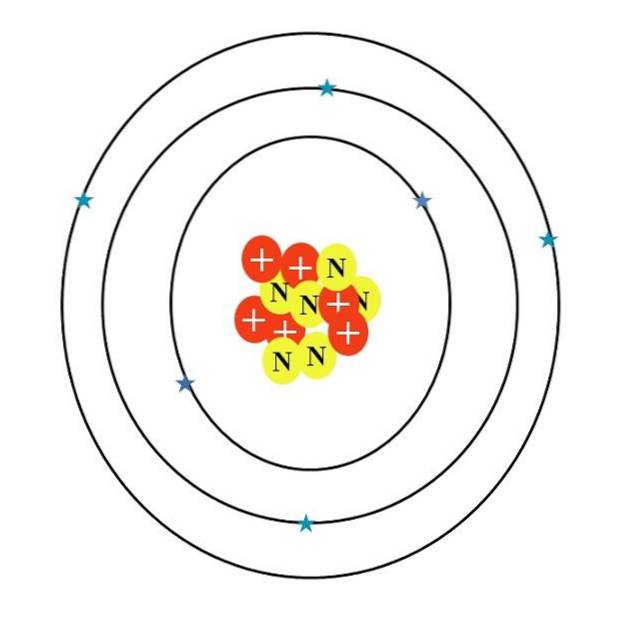
O átomo de carbono é simbolizado pela letra C. Seu número atômico Z é 6, portanto possui seis prótons (círculos vermelhos com o símbolo "+" no núcleo). Além disso, possui seis nêutrons (círculos amarelos com a letra "N") e, finalmente, seis elétrons (estrelas azuis).
A soma das massas de suas partículas atômicas dá um valor médio de 12,0107 u. No entanto, o átomo na imagem corresponde ao isótopo de carbono 12 (12C), que consiste em d. Outros isótopos, como 13C e 14C, menos abundante, varia apenas no número de nêutrons.
Assim, se esses isótopos fossem desenhados, o 13C teria um círculo amarelo adicional e o 14C, mais dois. Isso logicamente significa que eles são átomos de carbono mais pesados..
Além disso, que outras características podem ser mencionadas a esse respeito? É tetravalente, ou seja, pode formar quatro ligações covalentes. Localiza-se no grupo 14 (IVA) da tabela periódica, mais especificamente no bloco p.
É também um átomo muito versátil, capaz de se ligar a quase todos os elementos da tabela periódica; especialmente consigo mesmo, formando macromoléculas e polímeros lineares, ramificados e laminares.
Estrutura
Qual é a estrutura de um átomo de carbono? Para responder a esta pergunta, primeiro você tem que ir para sua configuração eletrônica: 1sdois2sdois2 Pdois ou [He] 2sdois2 Pdois.
Portanto, existem três orbitais: os 1sdois, os 2sdois e o 2pdois, cada um com dois elétrons. Isso também pode ser visto na imagem acima: três anéis com dois elétrons (estrelas azuis) cada (não confunda os anéis com órbitas: eles são orbitais).
Observe, no entanto, que duas das estrelas têm um tom de azul mais escuro do que as outras quatro. Por quê? Porque os dois primeiros correspondem à camada interna 1sdois ou [He], que não participa diretamente da formação das ligações químicas; enquanto os elétrons da camada externa, 2s e 2p, fazem.
Os orbitais s e p não têm a mesma forma, então o átomo ilustrado não está de acordo com a realidade; além da grande desproporção da distância entre os elétrons e o núcleo, que deveria ser centenas de vezes maior..
Portanto, a estrutura do átomo de carbono consiste em três orbitais onde os elétrons "derretem" em nuvens eletrônicas borradas. E entre o núcleo e esses elétrons existe uma distância que revela o imenso “vácuo” dentro do átomo..
Hibridização
Foi mencionado anteriormente que o átomo de carbono é tetravalente. De acordo com sua configuração eletrônica, seus elétrons 2s estão emparelhados e os elétrons 2p desemparelhados:
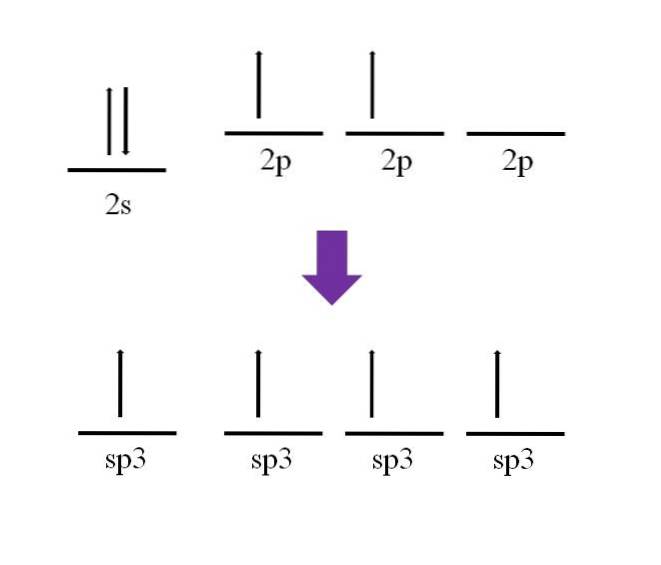
Um orbital p está disponível, o qual está vazio e preenchido com um elétron adicional no átomo de nitrogênio (2p3).
De acordo com a definição da ligação covalente, é necessário que cada átomo contribua com um elétron para sua formação; no entanto, pode ser visto que no estado de linha de base do átomo de carbono, ele tem apenas dois elétrons desemparelhados (um em cada orbital 2p). Isso significa que neste estado é um átomo divalente e, portanto, forma apenas duas ligações (-C-).
Então, como é possível que o átomo de carbono forme quatro ligações? Para fazer isso, você deve promover um elétron do orbital 2s para o orbital 2p de alta energia. Feito isso, os quatro orbitais resultantes são degenerar; em outras palavras, eles têm a mesma energia ou estabilidade (observe que eles estão alinhados).
Este processo é conhecido como hibridização e, graças a ele, o átomo de carbono passou a ter quatro orbitais sp3 com um elétron cada para formar quatro ligações. Isso se deve à sua característica de ser tetravalente.
sp3
Quando o átomo de carbono tem uma hibridização sp3, orienta seus quatro orbitais híbridos aos vértices de um tetraedro, que é sua geometria eletrônica.
Assim, pode-se identificar um sp de carbono3 porque ele forma apenas quatro ligações simples, como na molécula de metano (CH4) E ao seu redor pode-se observar um ambiente tetraédrico.
A sobreposição de orbitais sp3 é tão eficaz e estável que a ligação C-C simples tem uma entalpia de 345,6 kJ / mol. Isso explica por que existem infinitas estruturas de carbonato e um número incomensurável de compostos orgânicos. Além disso, os átomos de carbono podem formar outros tipos de ligações.
spdois e sp
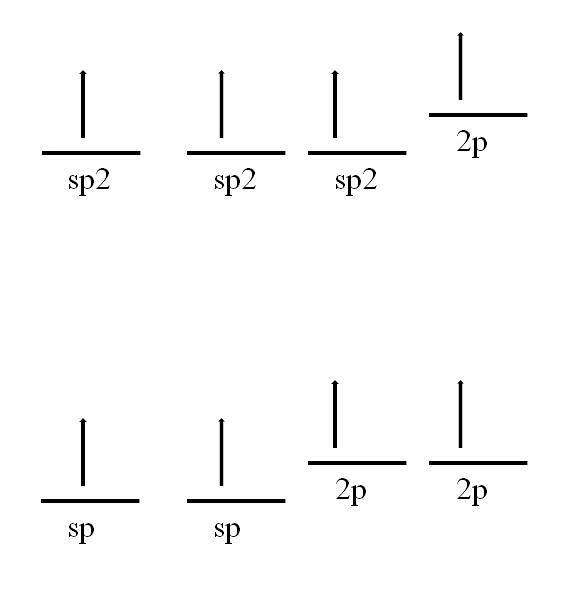
O átomo de carbono também é capaz de adotar outras hibridizações, o que lhe permitirá formar uma ligação dupla ou mesmo tripla.
Hibridização in spdois, como pode ser visto na imagem, existem três orbitais spdois degenerar e um orbital 2p permanece inalterado ou "puro". Com os três orbitais spdois A 120º de distância, o carbono forma três ligações covalentes desenhando uma geometria eletrônica plana trigonal; enquanto com o orbital 2p, perpendicular aos outros três, forma uma ligação π: -C = C-.
No caso da hibridização sp, existem dois orbitais sp afastados 180º, de forma que traçam uma geometria eletrônica linear. Desta vez, eles têm dois orbitais 2p puros, perpendiculares entre si, que permitem ao carbono formar ligações triplas ou duas ligações duplas: -C≡C- ou ·· C = C = C ·· (o carbono central tem hibridização sp ).
Observe que sempre (geralmente) se as ligações ao redor do carbono forem adicionadas, será descoberto que o número é igual a quatro. Esta informação é essencial ao desenhar estruturas de Lewis ou estruturas moleculares. Um átomo de carbono formando cinco ligações (= C≡C) é teoricamente e experimentalmente inadmissível.
Classificação
Como os átomos de carbono são classificados? Mais do que uma classificação por características internas, na verdade depende do ambiente molecular. Ou seja, dentro de uma molécula seus átomos de carbono podem ser classificados de acordo com o seguinte.
Primário
Um carbono primário é aquele que está ligado apenas a um outro carbono. Por exemplo, a molécula de etano, CH3-CH3 Consiste em dois carbonos primários ligados. Isso sinaliza o fim ou início de uma cadeia de carbono.
Secundário
É aquele que está ligado a dois carbonos. Assim, para a molécula de propano, CH3-CHdois-CH3, o átomo de carbono do meio é secundário (o grupo metileno, -CHdois-).
Terciário
Os carbonos terciários diferem dos demais porque a partir deles surgem ramos da cadeia principal. Por exemplo, 2-metilbutano (também chamado de isopentano), CH3-CH(CH3) -CHdois-CH3 tem um carbono terciário destacado em negrito.
Quaternário
E, finalmente, os carbonos quaternários, como o nome indica, estão ligados a quatro outros átomos de carbono. A molécula de neopentano, C(CH3)4 possui um átomo de carbono quaternário.
Formulários
Unidade de massa atômica
A massa atômica média do 12C é usado como uma medida padrão para calcular as massas dos outros elementos. Assim, o hidrogênio pesa um duodécimo desse isótopo de carbono, que é usado para definir o que é conhecido como unidade de massa atômica u.
Assim, as outras massas atômicas podem ser comparadas com a do 12C e o 1H. Por exemplo, magnésio (24Mg) pesa aproximadamente duas vezes o peso de um átomo de carbono e 24 vezes mais do que um átomo de hidrogênio.
Ciclo de carbono e vida
As plantas absorvem COdois no processo de fotossíntese para liberar oxigênio na atmosfera e atuar como pulmões de plantas. Quando morrem, se transformam em carvão, que após a queima, libera CO novamentedois. Uma parte volta para as plantas, mas outra acaba no fundo do mar, nutrindo muitos microrganismos.
Quando os microrganismos morrem, o sólido permanece em sua decomposição biológica sedimentando-se e, após milhões de anos, transforma-se no que se conhece como óleo..
Quando a humanidade usa este óleo como fonte de energia alternativa à queima de carvão, contribui para a liberação de mais CO.dois (e outros gases indesejáveis).
Por outro lado, a vida usa átomos de carbono de dentro. Isso se deve à estabilidade de suas ligações, o que lhe permite formar cadeias e estruturas moleculares que compõem macromoléculas tão importantes quanto o DNA..
Espectroscopia NMR 13C
O 13C, embora seja em uma proporção muito menor do que a do 12C, sua abundância é suficiente para elucidar estruturas moleculares por espectroscopia de ressonância magnética nuclear de carbono 13.
Graças a esta técnica de análise, é possível determinar quais átomos circundam o 13C e a quais grupos funcionais eles pertencem. Assim, o esqueleto de carbono de qualquer composto orgânico pode ser determinado..
Referências
- Graham Solomons T.W., Craig B. Fryhle. Química orgânica. Aminas. (10ª edição.) Wiley Plus.
- Blake D. (04 de maio de 2018). Quatro características do carbono. Recuperado de: sciencing.com
- Royal Society of Chemistry. (2018). Carvão. Retirado de: rsc.org
- Compreendendo a evolução. (s.f.). Viagem de um átomo de carbono. Recuperado de: evolution.berkeley.edu
- Encyclopædia Britannica. (14 de março de 2018). Carvão. Recuperado de: britannica.com
- Pappas S. (29 de setembro de 2017). Fatos sobre o carbono. Recuperado de: livescience.com



Ainda sem comentários