
Estrutura butanal, propriedades, usos e riscos
O butanal é um aldeído de cadeia aberta, composto de quatro átomos de carbono, e é análogo ao butano; é de fato a segunda forma mais oxidada do hidrocarboneto butano depois do ácido butírico. Sua fórmula molecular é CH3CHdoisCHdoisCHO, onde -CHO é o grupo formil.
Esse aldeído, um dos mais leves, consiste em um líquido transparente, inflamável, menos denso que a água. Além disso, é solúvel em água e miscível com a maioria dos solventes orgânicos; portanto, pode ser usado para ter misturas orgânicas de fase única.
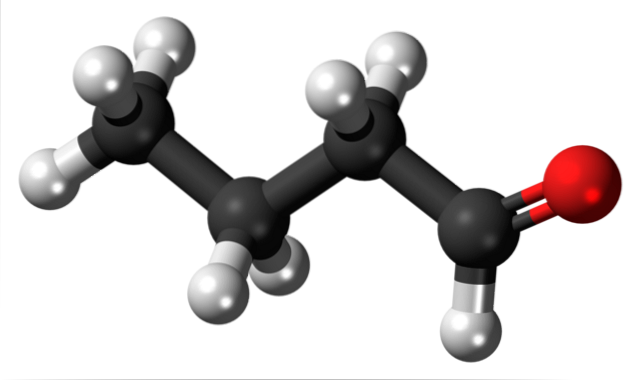
A presença do grupo carbonila (o da esfera vermelha, imagem superior) dá polaridade química à molécula de butanal e, portanto, a capacidade de experimentar a interação dipolo-dipolo entre suas moléculas; embora nenhuma ligação de hidrogênio seja formada entre eles.
Isso resulta no butanal com pontos de ebulição e fusão mais altos do que o butano, mas menores do que os apresentados pelo álcool n-butílico..
Butanal é usado como solvente e é um intermediário para a obtenção de inúmeros produtos; como aceleradores de vulcanização para borrachas, resinas, produtos farmacêuticos e agroquímicos.
Butanal é um composto tóxico que por inalação pode causar inflamação do trato respiratório superior, brônquios e edema pulmonar que pode até ter consequências fatais.
Índice do artigo
- 1 Estrutura do butanal
- 1.1 Conformadores
- 2 propriedades
- 2.1 Nomes químicos
- 2.2 Fórmula molecular
- 2.3 Aparência física
- 2.4 Odor
- 2,5 ponto de ebulição
- 2.6 Ponto de fusão
- 2.7 Ponto de fulgor
- 2.8 Solubilidade em água
- 2.9 Solubilidade em solventes orgânicos
- 2.10 Densidade
- 2.11 Densidade de vapor
- 2.12 Pressão de vapor
- 2.13 Autoignição
- 2,14 Viscosidade
- 2,15 Calor de combustão
- 2.16 Calor de vaporização
- 2.17 Tensão superficial
- 2,18 Limite de odor
- 2,19 Índice de refração
- 2,20 momento dipolo
- 2.21 Comprimentos de onda (λ) de absorção máxima na água
- 2.22 Polimerização
- 2.23 Reatividade
- 2.24 Condensação de Aldol
- 3 Síntese
- 4 usos
- 4.1 Industrial
- 4.2 Outros
- 5 riscos
- 6 referências
Estrutura butanal
Acabamos de mencionar que o grupo formil, -CHO, confere polaridade à molécula de butanal ou butiraldeído devido à maior eletronegatividade do átomo de oxigênio. Como resultado disso, suas moléculas podem interagir umas com as outras por meio de forças dipolo-dipolo..
Na imagem superior é mostrado, com um modelo de esferas e barras, que a molécula do butanal possui estrutura linear. O carbono do grupo -CHO possui hibridização spdois, enquanto os carbonos restantes hibridização3.
Não só isso, mas também é flexível, e seus links podem girar em seus próprios eixos; e assim, diferentes conformações ou conformações são geradas (mesmo composto, mas com seus elos girados).
Conformadores
A imagem a seguir explica melhor esse ponto:
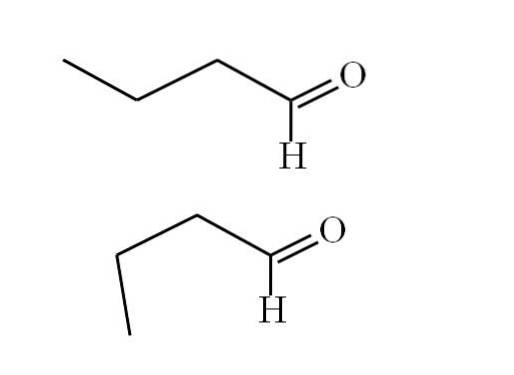
O primeiro conformador (o superior) corresponde à molécula na primeira imagem: o grupo metil à esquerda, -CH3, e o grupo -CHO, estão em posições antiparalelas entre si; um aponta para cima e o outro para baixo, respectivamente.
Enquanto isso, o segundo conformador (o inferior) corresponde à molécula com -CH3 e o -CHO em posições eclipsadas; ou seja, ambos apontam na mesma direção.
Ambos os conformadores são rapidamente intercambiáveis e, portanto, a molécula butanal está constantemente girando e vibrando; e somado ao fato de possuir um dipolo permanente, isso permite que suas interações sejam fortes o suficiente para ferver a 74,8ºC..
Propriedades
Nomes químicos
-Butanal
-Butiraldeído
-1-Butanal
-Butiral
-N-Butiraldeído.
Fórmula molecular
C4H8O ou CH3CHdoisCHdoisCHO.
Aspecto físico
É um líquido límpido e transparente.
Odor
Odor característico, pungente, de aldeído.
Ponto de ebulição
167ºF a 760mmHg (74,8ºC).
Ponto de fusão
-146 ºF (-96,86 ºC).
ponto de ignição
-Copo fechado 8ºF (-22ºC).
Solubilidade em água
7 g / 100 mL a 25 ºC.
Solubilidade em solventes orgânicos
Miscível com etanol, éter, acetato de etila, acetona, tolueno e muitos outros solventes orgânicos.
Densidade
0,803 g / cm3 a 68ºF.
Densidade do vapor
2,5 (em relação ao ar captado igual a 1).
Pressão de vapor
111 mmHg a 25 ºC.
Autoignição
446ºF. 425ºF (21,8ºC).
Viscosidade
0,45 cPoise a 20 ° C.
Calor de combustão
2479,34 kJ / mol a 25 ºC.
Calor da vaporização
33,68 kJ / mol a 25 ºC.
Tensão superficial
29,9 dine / cm a 24 ºC.
Limiar de odor
0,009 ppm.
Índice de refração
1,3843 a 20 ºC.
Momento dipolo
2,72 D.
Comprimentos de onda (λ) de absorção máxima na água
225 nm e 282 nm (luz ultravioleta).
Polimerização
O butanal pode polimerizar em contato com álcalis ou ácidos, sendo a polimerização perigosa.
Reatividade
Quando exposto ao ar oxida, formando ácido butírico. A uma temperatura de 230ºC, butanal inflama-se espontaneamente com o ar.
Condensação aldólica
Duas moléculas de butanal podem reagir entre si, na presença de KOH e a uma temperatura de 6-8 ° C, para formar o composto 2-etil-3-hidroxihexanol. Esse tipo de composto é denominado aldol, pois possui em sua estrutura um grupo aldeído e um grupo alcoólico..
Síntese
O butanal pode ser produzido pela desidrogenação catalítica do álcool n-butílico; a hidrogenação catalítica do crotonaldeído; e a hidroformilação de propileno.
Formulários
Industrial
-O butanal é um solvente industrial, mas também é um intermediário na síntese de outros solventes; por exemplo 2-etilhexanol, n-butanol e trimetilpropano.
-É também utilizado como intermediário na produção de resinas sintéticas, incluindo polivinilbutiral; aceleradores de vulcanização de borracha; fabricação de produtos farmacêuticos; produtos de proteção de colheitas; pesticidas; antioxidantes; auxiliares de bronzeamento.
-O butanal é utilizado como matéria-prima para a produção de aromas sintéticos. Além disso, é usado como um agente aromatizante de alimentos.
Outras
-No homem, o butanal é usado como um biomarcador indicativo de dano oxidativo sofrido por lipídios, proteínas e ácidos nucléicos.
-Foi utilizado experimentalmente, junto com a formalina e o glutardeído, para tentar reduzir o amolecimento experimentado pelos cascos dos bovinos, devido à exposição à água, urina e fezes do próprio gado. Os resultados experimentais foram positivos.
Riscos
O butanal é destrutivo para as membranas mucosas do trato respiratório superior, bem como para os tecidos da pele e dos olhos..
O contato com a pele causa vermelhidão e queimaduras. Nos olhos, ocorrem as mesmas lesões, acompanhadas de dor e danos ao tecido ocular.
A inalação de butanal pode ter consequências graves, pois pode causar inflamação e edema na laringe e brônquios; enquanto nos pulmões, produz pneumonia química e edema pulmonar.
Os sinais de superexposição incluem: sensação de queimação no trato respiratório superior, tosse, respiração ofegante, ou seja, chiado ao respirar; laringite, falta de ar, dor de cabeça, náuseas e também vômitos.
A inalação pode ser fatal como resultado de espasmo do trato respiratório.
A ingestão de butanal causa sensação de "queimação" no trato digestivo: cavidade oral, faringe, esôfago e estômago.
Referências
- Morrison, R. T. e Boyd, R. N. (1987). Quimica Organica. (5ta Edição.). Editorial Addison-Wesley Iberoamericana.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- PubChem. (2019). Butanal. Recuperado de: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Recuperado de: es.wikipedia.org
- Livro Químico. (2017). Butanal. Recuperado de: chemicalbook.com
- Basf. (Maio de 2017). N-butiraldeído. [PDF]. Recuperado de: solvents.basf.com



Ainda sem comentários