
Propriedades, riscos e usos do cloreto de lítio (LiCl)
O Cloreto de lítio É um composto químico da fórmula LiCl que pode ser feito pela ignição do lítio e do cloro, embora seja difícil porque a reação é violenta. Desta forma, a forma anidra (sem água) é produzida. O cloreto de lítio também pode ser extraído de outros cloretos de metal alcalino com álcool amílico..
Até a década de 1990, o mercado de metal e lítio era dominado pela produção norte-americana de depósitos minerais. No entanto, no início do século 21, a maior parte da produção era proveniente de fontes não americanas, sendo Austrália, Chile e Portugal os fornecedores mais importantes do mundo..
A título de curiosidade, é importante notar que, embora a Bolívia possua metade dos depósitos de lítio do mundo, não é um grande produtor..
A forma comercial mais importante é o carbonato de lítio, LidoisCO3, produzido a partir de minerais ou salmouras por vários processos diferentes.
A adição de ácido clorídrico (HCl) produz cloreto de lítio. Com esse método, o composto hidratado (água ligada à molécula) é produzido. A forma hidratada pode ser seca até a forma anidra por aquecimento com ácido clorídrico gasoso..
Propriedades físicas e químicas do cloreto de lítio
O cloreto de lítio é um sólido branco sem aroma particular e com sabor salgado (National Center for Biotechnology Information, 2005). Sua aparência é mostrada na figura 2.

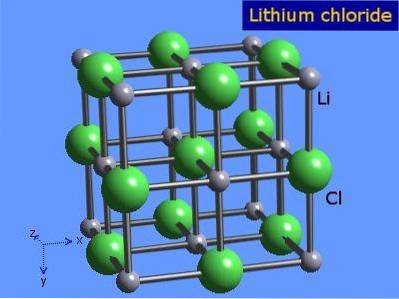
O cloreto de lítio são cristais altamente higroscópicos com geometria octaédrica semelhante à do cloreto de sódio. Sua estrutura cristalina é apresentada na figura 3 (Winter, S.F.).
Seu peso molecular é de 42,39 g / mol, sua densidade é de 2,068 g / mL e seus pontos de fusão e ebulição são 605 ºC e 1360 ºC, respectivamente..
O composto é muito solúvel em água, álcool, éter, piridina e nitrobenzeno (Royal Society of Chemistry, 2015).
O cloreto de lítio tem um fraco poder de oxidação ou redução. No entanto, ainda podem ocorrer reações redox. As soluções de cloreto de lítio geralmente não são nem fortemente ácidas nem fortemente básicas..
Por ser extremamente higroscópico, o cloreto de lítio também pode absorver até quatro equivalentes de amônia por mol. Soluções aquosas de cloreto de lítio podem corroer metais (LITHIUM CHLORIDE, S.F.).
Reatividade e perigos
O cloreto de lítio é um composto estável incompatível com agentes oxidantes fortes, ácidos fortes, tricloreto de bromo, trifluoreto de bromo.
Não é tóxico se ingerido, mas devido à sua natureza corrosiva pode ser irritante em contato com a pele e os olhos, podendo também irritar as vias nasais (National Institute for Occupational Safety and Health, 2015).
Em caso de contato com os olhos, verifique se está usando lentes de contato e remova-as imediatamente..
Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada. Pomada para os olhos não deve ser usada.
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas próprias mãos e corpo.
Coloque a vítima sob um chuveiro de emergência. Se o produto químico se acumular na pele exposta da vítima, como nas mãos, a pele contaminada deve ser lavada com cuidado e cuidado com água corrente e sabão não abrasivo..
Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de usá-la novamente.
Em caso de inalação, a vítima deve ser deixada repousar em área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível..
Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata. Se a vítima tiver dificuldade para respirar, deve-se administrar oxigênio.
Se a vítima não estiver respirando, a ressuscitação boca a boca é realizada. Sempre tendo em mente que pode ser perigoso para a pessoa que está prestando socorro fazer reanimação boca a boca quando o material inalado for tóxico, infeccioso ou corrosivo..
Em todos os casos, deve-se procurar atendimento médico imediato (Folha de Dados de Segurança do Material, cloreto de lítio, 2013).
Formulários
O cloreto de lítio é o composto usado para produzir metal de lítio por eletrólise. O metal de lítio é produzido por eletrólise de uma mistura fundida de cloretos de lítio e potássio.
O ponto de fusão mais baixo da mistura (400-420 ° C ou 750-790 ° F) em comparação com o do cloreto de lítio puro (610 ° C ou 1130 ° F) permite a operação em temperatura mais baixa da eletrólise.
Uma vez que a voltagem na qual ocorre a decomposição do cloreto de lítio é menor do que a do cloreto de potássio, o lítio é depositado em um nível de pureza superior a 97 por cento (Dye, 2017).
O cloreto de lítio líquido serve como um dessecante que pode reduzir os níveis de umidade no ar circundante em até 15 por cento.
Os dessecantes líquidos que combinam cloreto de lítio e cloreto de cálcio criam uma substância que é mais barata do que o cloreto de lítio, mas mais estável do que o cloreto de cálcio..
O cloreto de lítio resfria o ar rapidamente porque o produto químico contém uma enorme quantidade de água para seu peso como sólido. A substância também seca grandes quantidades de gases industriais.
O cloreto de lítio é um corante vermelho em exibições pirotécnicas, como fogos de artifício. Cloreto de lítio, ou qualquer sal à base de lítio solúvel em água, queima em vermelho quando ligado.
Efeitos pirotécnicos especiais podem ser desencadeados pela mistura de sais iônicos com líquidos inflamáveis, como álcool metílico..
Na década de 1940, o cloreto de lítio serviu como substituto do sal de cozinha, mas alguns pacientes morreram devido aos níveis tóxicos de lítio..
O composto tem aplicações farmacológicas como antimaníacos, que são agentes usados para tratar transtornos bipolares ou mania associados a outros transtornos afetivos..
O corpo humano normalmente contém cerca de 7 miligramas de lítio a qualquer momento..
O lítio ocorre naturalmente nas plantas, pois os organismos usam a substância para estimular o crescimento.
Referências
- Dye, J. L. (2017, 23 de janeiro). Lítio (Li). Recuperado da britannica: britannica.com.
- EMBL-EBI. (23 de novembro de 2009). cloreto de lítio. Recuperado de ChEBI: ebi.ac.uk.
- CLORETO DE LÍTIO. (S.F.). Recuperado de CAMEO: cameochemicals.noaa.gov.
- Folha de dados de segurança de material cloreto de lítio. (2013, 21 de maio). Recuperado de sciencelab.com.
- National Center for Biotechnology Information ... (2005, 26 de março). PubChem Compound Database; CID = 433294. Obtido em PubChem.
- Instituto Nacional de Segurança e Saúde Ocupacional. (2015, 22 de julho). CLORETO DE LÍTIO. Recuperado de cdc.gov.
- Winter, M. (S.F.). Lítio: cloreto de lítio. Recuperado de elementos da web.

Ainda sem comentários