
Estrutura, propriedades, usos, riscos do brometo de lítio
O brometo de lítio é um sal neutro de um metal alcalino cuja fórmula química é LiBr. A fórmula expressa que seu sólido cristalino é composto de íons Li+ e Br- em uma proporção de 1: 1. Seus cristais são brancos ou bege claro. É muito solúvel em água e também um sal bastante higroscópico..
Esta última propriedade permite seu uso como dessecante em sistemas de ar condicionado e refrigeração. Da mesma forma, o brometo de lítio foi utilizado desde o início do século XX no tratamento de certos transtornos mentais, sendo seu uso abandonado devido ao uso inadequado de sal..
LiBr é produzido pelo tratamento de carbonato de lítio, LidoisCO3, com ácido bromídrico. Depois de aquecer o meio, ele precipita da solução aquosa como um hidrato..
Este sal irrita a pele e os olhos em contato, enquanto causa irritação das vias respiratórias por inalação. A ingestão de sais de lítio pode causar náuseas, vômitos, diarreia e tonturas.
Índice do artigo
- 1 Estrutura do brometo de lítio
- 1.1 Hidratos e vidros
- 2 propriedades
- 2.1 Peso molecular
- 2.2 Aparência
- 2.3 Odor
- 2.4 Ponto de fusão
- 2,5 ponto de ebulição
- 2.6 Solubilidade em água
- 2.7 Solubilidade em solventes orgânicos
- 2.8 Índice de refração (ηD)
- 2.9 Capacidade de calor
- 2.10 Entropia molar padrão (Sθ 298)
- 2.11 Ponto de fulgor
- 2.12 Estabilidade
- 2.13 Decomposição
- 2,14 pH
- 2,15 Reatividade
- 2,16 Produção
- 3 Nomenclatura
- 4 usos
- 4.1 Dessecante
- 4,2 Fibras
- 4.3 Produtos farmacêuticos
- 4,4 sedativo
- 5 riscos
- 5.1 Toxicidade de contato
- 5.2 Ingestão
- 6 referências
Estrutura do brometo de lítio
A fórmula LiBr deixa claro que a relação Li / Br é igual a 1; para cada Li cation+ deve haver um irmão- contrapartida. Portanto, essa proporção deve ser mantida constante em todos os cantos do cristal LiBr..
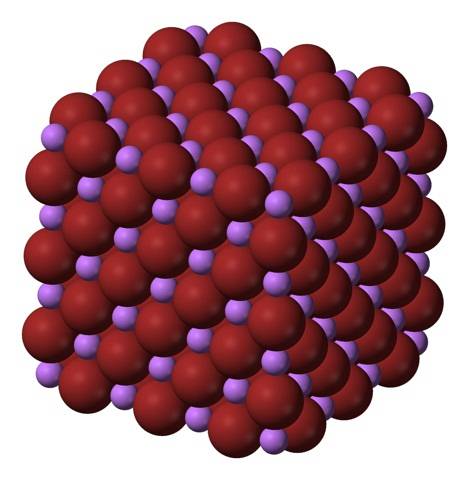
Íons de lítio+ e Br- eles se atraem, diminuindo as repulsões entre cargas iguais, para assim originar um cristal cúbico como o sal de gema; isto é isomórfico ao NaCl (imagem superior). Observe que, por si só, todo o conjunto tem uma geometria cúbica.
Neste cristal, o Li+ eles são menores e têm uma cor roxa clara; enquanto o Br- são mais volumosos e de cor castanha escura. Observa-se que cada íon possui seis vizinhos, o que equivale a dizer que apresentam uma coordenação octaédrica: LiBr6 ou Li6Br; no entanto, se a célula unitária for considerada, a razão Li / Br permanece 1.
Esta é a estrutura cristalina preferencialmente adotada pelo LiBr. No entanto, também pode formar outros tipos de cristais: wurzita, se cristalizar a baixas temperaturas (-50 ° C) sobre um substrato; ou cúbica centrada no corpo, ou do tipo CsCl, se o cristal de sal de gema cúbica for submetido a alta pressão.
Hidratos e óculos
O anterior é aplicável para LiBr anidro. Esse sal é higroscópico e, portanto, pode absorver a umidade do meio ambiente, inserindo moléculas de água em seus próprios cristais. Assim, surgem os hidratos LiBrnHdoisO (n = 1, 2, 3…, 10). Para cada hidrato, a estrutura cristalina é diferente.
Por exemplo, estudos cristalográficos determinaram que LiBrHdoisOu adote uma estrutura semelhante à perovskita.
Quando esses hidratos estão em solução aquosa, eles podem super-resfriar e vitrificar; ou seja, eles adotam uma estrutura aparentemente cristalina, mas molecularmente desordenada. Sob tais condições, as ligações de hidrogênio na água tornam-se muito importantes..
Propriedades
Peso molecular
88,845 g / mol.
Aparência
Sólido cristalino branco ou bege claro.
Odor
Banheiro.
Ponto de fusão
552 ºC (1.026 ºF, 825 K).
Ponto de ebulição
1.256 ºC (2.309 ºF, 1.538 K).
Solubilidade em água
166,7 g / 100 mL a 20 ° C Observe sua alta solubilidade.
Solubilidade em solventes orgânicos
Solúvel em metanol, etanol, éter e acetona. Ligeiramente solúvel em piridina, um composto aromático e menos polar que os anteriores.
Índice de refração (ηD)
1.784.
Capacidade calórica
51,88 J / mol K.
Entropia molar padrão (Sθ 298)
66,9 J / mol K.
ponto de ignição
1.265 ° C É considerado não inflamável.
Estabilidade
Estábulo. A forma anidra, no entanto, é extremamente higroscópica.
Decomposição
Quando decomposto por aquecimento, produz óxido de lítio.
pH
Entre pH 6 e 7 em solução aquosa (100 g / L, 20 ºC).
Reatividade
O brometo de lítio não é reativo em condições ambientais normais. No entanto, você pode experimentar fortes reações com ácidos fortes à medida que a temperatura aumenta..
Ao se dissolver em água, ocorre um aumento da temperatura, ocasionado por uma entalpia de hidratação negativa.
Produção
LiBr é produzido pela reação de hidróxido de lítio ou carbonato de lítio com ácido bromídrico em uma reação de neutralização:
LidoisCO3 + HBr => LiBr + COdois + HdoisOU
O brometo de lítio é obtido como um hidrato. Para obter a forma anidra, é necessário aquecer o sal hidratado sob vácuo..
Nomenclatura
O nome 'brometo de lítio' deriva do fato de ser um haleto de metal, assim denominado de acordo com a nomenclatura de estoque. Outros nomes, igualmente válidos, mas menos usados, são monobrometo de lítio, de acordo com a nomenclatura sistemática; e brometo lítico (a valência única de +1 para o lítio), de acordo com a nomenclatura tradicional.
Formulários
Dessecante
LiBr é um sal higroscópico, formando uma salmoura concentrada capaz de absorver a umidade do ar em uma ampla faixa de temperaturas. Esta salmoura é usada como dessecante em sistemas de ar condicionado e refrigeração..
Fibras
É usado para aumentar o volume de lã, cabelo e outras fibras orgânicas.
Adutos Farmacêuticos
O LiBr forma adutos com alguns compostos farmacêuticos, modulando sua ação. Um aduto é a combinação por coordenação de duas ou mais moléculas, sem produzir uma alteração estrutural de nenhuma das moléculas unidas..
Sedativo
O brometo de lítio foi usado pela primeira vez como sedativo em certos transtornos mentais e foi descontinuado em 1940. Atualmente, o carbonato de lítio é usado; mas em qualquer caso, o lítio é o elemento que exerce a ação terapêutica em ambos os compostos.
O lítio é utilizado no tratamento do transtorno bipolar, tendo sido útil no controle dos episódios maníacos do transtorno. Acredita-se que o lítio iniba a atividade de neurotransmissores excitatórios, como a dopamina e o ácido glutâmico.
Por outro lado, aumenta a atividade do sistema inibitório mediado pelo neurotransmissor ácido gama-amino-butírico (GABA). Essas ações podem fazer parte da base da ação terapêutica do lítio.
Riscos
Toxicidade de contato
Irritação e sensibilização da pele, alergias. Lesões oculares graves ou irritação aos olhos, trato respiratório, vias nasais e garganta.
Ingestão
Os principais sintomas decorrentes da ingestão de brometo de lítio são: distúrbios gastrointestinais, vômitos e náuseas. Outros efeitos adversos da ingestão de sal incluem agitação, espasmos e perda de consciência..
A condição conhecida como "bromismo" pode ocorrer com doses de brometo de lítio superiores a 225 mg / dia..
Alguns dos seguintes sinais e sintomas podem ocorrer em piadas: exacerbação da acne e perda de apetite, tremores, problemas de fala, apatia, fraqueza e agitação maníaca.
Referências
- Formulação Química. (2019). Brometo de lítio. Recuperado de: formulacionquimica.com
- David C. Johnson. (10 de julho de 2008). Novo pedido de brometo de lítio. Natureza. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Transição de fase estrutural em brometo de lítio: efeito da pressão e da temperatura. [PDF]. Recuperado de: ncpcm.in
- Takamuku et al. (1997). Estudos de difração de raios-X em soluções de brometo de lítio aquoso super-resfriado e iodeto de lítio. Departamento de Química, Faculdade de Ciências, Universidade de Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Japão.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Brometo de lítio. Banco de dados PubChem, CID = 82050. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Brometo de lítio. Recuperado de: en.wikipedia.org
- Royal Society of Chemistry. (2019). Brometo de lítio. Chemspider. Recuperado de: chemspider.com

Ainda sem comentários