
Estrutura, propriedades, riscos e usos do bicarbonato de cálcio
O bicarbonato de cálcio é um sal inorgânico com a fórmula química Ca (HCO3)dois. Origina-se na natureza do carbonato de cálcio presente nas pedras de calcário e minerais como a calcita.
O bicarbonato de cálcio é mais solúvel em água do que o carbonato de cálcio. Essa característica tem permitido a formação de sistemas cársticos nas rochas calcárias e na estruturação de cavernas..

A água subterrânea que passa pelas fissuras fica saturada em seu deslocamento de dióxido de carbono (COdois) Essas águas corroem as rochas calcárias liberando carbonato de cálcio (CaCO3) que formará o bicarbonato de cálcio, de acordo com a seguinte reação:
Ladrão3(s) + COdois(g) + HdoisO (l) => Ca (HCO3)dois(aq)
Essa reação ocorre em cavernas onde se originam águas muito duras. O bicarbonato de cálcio não está no estado sólido, mas sim em solução aquosa, junto com o Cadois+, bicarbonato (HCO3-) e o íon carbonato (CO3dois-).
Posteriormente, ao diminuir a saturação do dióxido de carbono na água, ocorre a reação reversa, ou seja, a transformação do bicarbonato de cálcio em carbonato de cálcio:
Ca (HCO3)dois(aq) => COdois (g) + HdoisO (l) + CaCO3 (s)
O carbonato de cálcio é pouco solúvel em água, o que faz com que sua precipitação ocorra como um sólido. A reação acima é muito importante na formação de estalactites, estalagmites e outros espeleotemas nas cavernas..
Essas estruturas rochosas são formadas a partir das gotas de água que caem do teto das cavernas (imagem superior). O CaCO3 presente nas gotículas de água, ele se cristaliza para formar as estruturas mencionadas.
O fato de o bicarbonato de cálcio não ser encontrado no estado sólido dificultou seu uso, havendo poucos exemplos. Da mesma forma, é difícil encontrar informações sobre seus efeitos tóxicos. Há relato de um conjunto de efeitos colaterais decorrentes de seu uso como tratamento para prevenção da osteoporose.
Estrutura
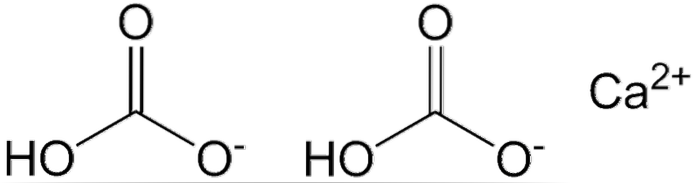
Dois ânions HCO são mostrados na imagem acima3- e um cátion Cadois+ interagindo eletrostaticamente. O CAdois+ de acordo com a imagem, deve estar localizado no meio, pois desta forma o HCO3- eles não se repeliriam por causa de suas cargas negativas.
A carga negativa em HCO3- desloca-se entre dois átomos de oxigênio, por meio de ressonância entre o grupo carbonila C = O e a ligação C-O-; enquanto no CO3dois-, é deslocalizado entre os três átomos de oxigênio, uma vez que a ligação C-OH é desprotonada e pode, portanto, receber uma carga negativa por ressonância.
As geometrias desses íons podem ser consideradas como esferas de cálcio rodeadas por triângulos planos de carbonatos com uma extremidade hidrogenada. Em termos de proporção de tamanho, o cálcio é visivelmente menor do que os íons HCO.3-.
Soluções aquosas
Ca (HCO3)dois Não pode formar sólidos cristalinos e, na verdade, consiste em soluções aquosas desse sal. Neles, os íons não estão sozinhos, como na imagem, mas rodeados por moléculas HdoisOU.
Como eles interagem? Cada íon é circundado por uma esfera de hidratação, que dependerá do metal, da polaridade e da estrutura das espécies dissolvidas..
O CAdois+ coordena-se com os átomos de oxigênio na água para formar um complexo aquoso, Ca (OHdois)ndois+, onde n é geralmente considerado seis; ou seja, um "octaedro aquoso" em torno do cálcio.
Enquanto ânions HCO3- interagir com ligações de hidrogênio (OdoisCO-H-OHdois) ou com os átomos de hidrogênio da água na direção da carga negativa deslocalizada (HOCOdois- H-OH, interação dipolo-íon).
Essas interações entre Cadois+, HCO3- e a água são tão eficientes que tornam o bicarbonato de cálcio muito solúvel nesse solvente; ao contrário de CaCO3, em que as atrações eletrostáticas entre Cadois+ e o CO3dois- são muito fortes, precipitando da solução aquosa.
Além da água, existem moléculas de COdois ao redor, que reagem lentamente para fornecer mais HCO3- (dependendo dos valores de pH).
Sólido hipotético
Até agora, os tamanhos e cargas dos íons em Ca (HCO3)dois, nem a presença de água, explique porque o composto sólido não existe; isto é, cristais puros que podem ser caracterizados por cristalografia de raios X. Ca (HCO3)dois não são nada mais do que íons presentes na água a partir dos quais as formações cavernosas continuam a crescer.
Sim Cadois+ e o HCO3- pode ser isolado da água evitando a seguinte reação química:
Ca (HCO3)dois(aq) → CaCO3(s) + COdois(g) + HdoisO (l)
Estes podem então ser agrupados em um sólido cristalino branco com razões estequiométricas de 2: 1 (2HCO3/ 1Ca). Não há estudos sobre sua estrutura, mas pode ser comparada à do NaHCO3 (uma vez que o bicarbonato de magnésio, Mg (HCO3)dois, não existe como um sólido também), ou com o de CaCO3.
Estabilidade: NaHCO3 vs Ca (HCO3)dois
NaHCO3 cristaliza no sistema monoclínico, e o CaCO3 nos sistemas trigonal (calcita) e ortorrômbico (aragonita). Se Na fosse substituído+ por Cadois+, a rede cristalina seria desestabilizada pela maior diferença de tamanhos; ou seja, o Na+ sendo menor, forma um cristal mais estável com HCO3- em comparação com Cadois+.
Na verdade, Ca (HCO3)dois(aq) precisa que a água evapore para que seus íons possam se agrupar em um cristal; mas sua estrutura cristalina não é forte o suficiente para fazê-lo em temperatura ambiente. Ao aquecer a água, ocorre a reação de decomposição (equação acima).
Ser o Naion+ em solução, formaria o cristal com o HCO3- antes de sua decomposição térmica.
A razão então porque Ca (HCO3)dois não cristaliza (teoricamente), é devido à diferença de raios iônicos ou tamanhos de seus íons, que não podem formar um cristal estável antes da decomposição.
Ca (HCO3)dois vs CaCO3
Se, por outro lado, H+ para estruturas de cristal de CaCO3, suas propriedades físicas mudariam drasticamente. Talvez, seus pontos de fusão caiam significativamente, e até mesmo as morfologias dos cristais acabem sendo modificadas..
Valeria a pena tentar a síntese de Ca (HCO3)dois sólido? As dificuldades podem exceder as expectativas, e um sal com baixa estabilidade estrutural pode não fornecer benefícios adicionais significativos em qualquer aplicação onde outros sais já sejam usados..
Propriedades físicas e químicas
Fórmula química
Ca (HCO3)dois
Peso molecular
162,11 g / mol
Estado físico
Não vem em estado sólido. É encontrado em solução aquosa e as tentativas de transformá-lo em um sólido por evaporação da água não tiveram sucesso, pois se tornou carbonato de cálcio.
Solubilidade em água
16,1 g / 100 ml a 0 ° C; 16,6 g / 100 ml a 20º C e 18,4 g / 100 ml a 100º C. Esses valores são indicativos de uma alta afinidade das moléculas de água pelos íons Ca (HCO3)dois, conforme explicado na seção anterior. Enquanto isso, apenas 15 mg de CaCO3 dissolver em um litro de água, refletindo suas fortes interações eletrostáticas.
Porque Ca (HCO3)dois não pode formar um sólido, sua solubilidade não pode ser determinada experimentalmente. No entanto, dadas as condições criadas pelo COdois dissolvido na água ao redor do calcário, a massa de cálcio dissolvida a uma temperatura T pode ser calculada; massa, que seria igual à concentração de Ca (HCO3)dois.
Em diferentes temperaturas, a massa dissolvida aumenta conforme mostrado pelos valores a 0, 20 e 100 ° C. Então, de acordo com esses experimentos, é determinado quanto de Ca (HCO3)dois dissolve-se na vizinhança de CaCO3 em um meio aquoso aerado com COdois. Assim que o CO escapardois gasoso, CaCO3 irá precipitar, mas não Ca (HCO3)dois.
Pontos de fusão e ebulição
A estrutura cristalina do Ca (HCO3)dois é muito mais fraco do que CaCO3. Se ele puder ser obtido no estado sólido, e a temperatura na qual ele derrete for medida em um fusiômetro, um valor certamente seria obtido bem abaixo de 899ºC. Da mesma forma, o mesmo seria esperado na determinação do ponto de ebulição..
Ponto de combustão
Sem combustível.
Riscos
Uma vez que este composto não existe na forma sólida, o manuseio de suas soluções aquosas não deve representar um risco, uma vez que ambos os íons de Cadois+ como HCO3- eles não são prejudiciais em baixas concentrações; e, portanto, o maior risco que seria ingerir essas soluções, só poderia ser devido a uma perigosa dose de cálcio ingerida.
Se o composto for formar um sólido, embora talvez fisicamente diferente do CaCO3, seus efeitos tóxicos podem não ir além do simples desconforto e ressecamento após contato físico ou inalação.
Formulários
-As soluções de bicarbonato de cálcio são usadas há muito tempo para lavar papéis antigos, especialmente obras de arte ou documentos historicamente importantes..
-O uso de soluções de bicarbonato é útil, não só porque neutralizam os ácidos do papel, mas também fornecem uma reserva alcalina de carbonato de cálcio. O último composto fornece proteção para danos futuros ao papel..
-Como outros bicarbonatos, é usado em leveduras químicas e em comprimidos efervescentes ou formulações em pó. Além disso, o bicarbonato de cálcio é usado como aditivo alimentar (soluções aquosas deste sal).
-Soluções de bicarbonato têm sido utilizadas na prevenção da osteoporose. No entanto, efeitos colaterais como hipercalcemia, alcalose metabólica e insuficiência renal foram observados em um caso..
-O bicarbonato de cálcio é ocasionalmente administrado por via intravenosa para corrigir o efeito depressivo da hipocalemia na função cardíaca.
-E, por fim, fornece cálcio ao organismo, que é mediador da contração muscular, ao mesmo tempo que corrige a acidose que pode ocorrer em um quadro de hipocalemia..
Referências
- Wikipedia. (2018). Bicarbonato de cálcio. Retirado de: en.wikipedia.org
- Sirah Dubois. (03 de outubro de 2017). O que é bicarbonato de cálcio? Recuperado de: livestrong.com
- Centro de Aprendizagem de Ciências. (2018). Química do carbonato. Recuperado de: sciencelearn.org.nz
- PubChem. (2018). Bicarbonato de cálcio. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Amy E. Gerbracht e Irene Brückle. (1997). O Uso de Soluções de Bicarbonato de Cálcio e Bicarbonato de Magnésio em Pequenas Oficinas de Conservação: Resultados de Pesquisa. Recuperado de: cool.conservation-us.org


Ainda sem comentários