
Hidrogênios benzil benzil, carbocations, radicais benzil
O benzil ou benzil é um grupo substituinte comum em química orgânica, cuja fórmula é C6H5CHdois- ou Bn-. Estruturalmente, consiste simplesmente na união de um grupo metileno, CHdois, com um grupo fenil, C6H5; ou seja, um sp de carbono3 diretamente ligado a um anel de benzeno.
Portanto, o grupo benzila pode ser visto como um anel aromático ligado a uma pequena cadeia. Em alguns textos, o uso da abreviatura Bn é preferido em vez de C6H5CHdois-, sendo facilmente reconhecido em qualquer composto; especialmente quando ligado a um átomo de oxigênio ou nitrogênio, O-Bn ou NBndois, respectivamente.

Este grupo também é encontrado implicitamente em vários compostos amplamente conhecidos. Por exemplo, para ácido benzóico, C6H5COOH, pode ser considerado como um benzil cujo carbono sp3 sofreu extensa oxidação; ou benzaldeído, C6H5CHO, de uma oxidação parcial; e álcool benzílico, C6H5CHdoisOH, ainda menos enferrujado.
Outro exemplo um tanto óbvio deste grupo pode ser encontrado em tolueno, C6H5CH3, que podem sofrer um certo número de reações como resultado da estabilidade incomum resultante de radicais benzila ou carbocations. No entanto, o grupo benzil serve para proteger os grupos OH ou NH.dois de reações que modificam indesejavelmente o produto a ser sintetizado.
Índice do artigo
- 1 Exemplos de compostos com grupo benzil
- 2 hidrogênios benzílicos
- 3 carbocations e radicais benzil
- 3.1 Ressonância no grupo benzil
- 3.2 Outros radicais
- 4 reações
- 5 referências
Exemplos de compostos com grupo benzil
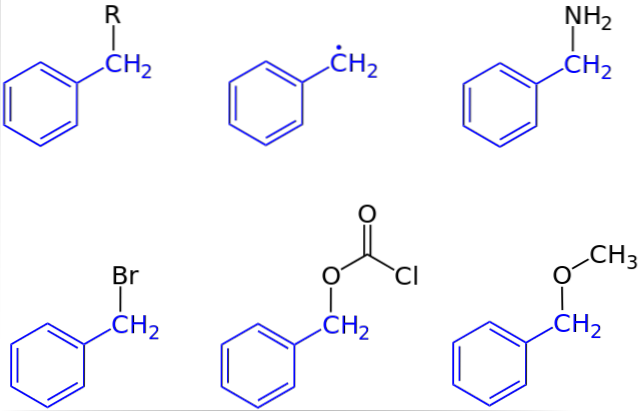
Na primeira imagem, a representação geral de um composto com um grupo benzila foi mostrada: C6H5CHdois-R, onde R pode ser qualquer outro fragmento molecular ou átomo. Assim, variando R um grande número de exemplos pode ser obtido; alguns simples, outros apenas para uma região específica de uma estrutura ou conjunto maior.
O álcool benzílico, por exemplo, é derivado da substituição de R: C por OH6H5CHdois-OH. Se em vez de OH for o grupo NHdois, então surge o composto de benzilamina: C6H5CHdois-NHdois.
Se Br é o átomo que substitui R, o composto resultante é o brometo de benzil: C6H5CHdois-Br; R para COdoisCl dá origem a um éster, clorocarbonato de benzilo (ou cloreto de carbobenzoxilo); e OCH3 dá origem a éter benzilmetílico, C6H5CHdois-OCH3.
Mesmo (embora não muito corretamente), R pode ser assumido por um elétron solitário: o radical benzil, C6H5CHdois·, Produto da libertação do radical R ·. Outro exemplo, embora não incluído na imagem, é fenilacetonitrila ou cianeto de benzila, C6H5CHdois-CN.
Existem compostos onde o grupo benzil dificilmente representa uma região específica. Quando este for o caso, a abreviatura Bn é freqüentemente usada para simplificar a estrutura e suas ilustrações..
Hidrogênios benzílicos
Os compostos anteriores têm em comum não apenas o anel aromático ou fenilo, mas também os hidrogénios benzílicos; estes são os que pertencem ao carbono sp3.
Esses hidrogênios podem ser representados como: Bn-CH3, Bn-CHdoisR ou Bn-CHRdois. O composto Bn-CR3 carece de hidrogênio benzílico e, portanto, sua reatividade é menor do que a dos outros.
Esses hidrogênios são diferentes daqueles que geralmente estão ligados a um carbono sp3.
Por exemplo, considere metano, CH4, que também pode ser escrito como CH3-H. Para o vínculo CH quebrar3-H em uma quebra heterolítica (formação de radical), uma certa quantidade de energia deve ser fornecida (104kJ / mol).
No entanto, a energia para a mesma quebra da ligação C6H5CHdois-H é menor em comparação com o metano (85 kJ / mol). Uma vez que esta energia é menor, isso implica que o radical C6H5CHdoisÉ mais estável do que CH3·. O mesmo acontece em maior ou menor grau com outros hidrogênios benzílicos.
Conseqüentemente, os hidrogênios benzílicos são mais reativos na geração de radicais ou carbocations mais estáveis do que aqueles causados por outros hidrogênios. Por quê? A pergunta é respondida na próxima seção.
Carbocações e radicais benzil
O radical C já foi considerado6H5CHdois·, Ausente do carbocátion benzil: C6H5CHdois+. No primeiro, há um elétron não pareado solitário e, no segundo, uma deficiência eletrônica. As duas espécies são muito reativas e representam compostos transitórios dos quais se originam os produtos finais da reação..
Carbono sp3, após perder um ou dois elétrons para formar o radical ou carbocátion, respectivamente, pode adotar a hibridização spdois (plano trigonal), de forma que haja a menor repulsão possível entre seus grupos eletrônicos. Mas, se acontecer de ser spdois, Como os carbonos do anel aromático, pode ocorrer conjugação? A resposta é sim.
Ressonância no grupo benzila
Esta conjugação ou ressonância é o fator chave para explicar a estabilidade dessas espécies benzil ou derivadas de benzil. A imagem a seguir ilustra esse fenômeno:
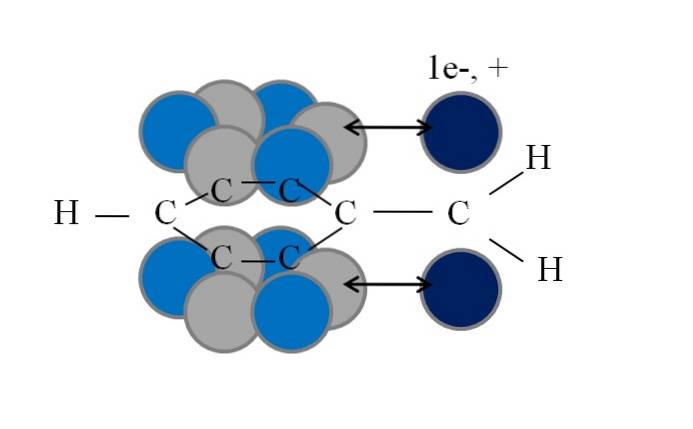
Observe que onde um dos hidrogênios benzílicos estava, um orbital permaneceu p com um elétron desemparelhado (radical, 1e-) ou vazio (carbocátion, +). Como pode ser visto, este orbital p é paralelo ao sistema aromático (os círculos cinza e azul claro), com a seta dupla indicando o início da conjugação.
Assim, tanto o elétron desemparelhado quanto a carga positiva podem ser transferidos ou dispersos através do anel aromático, uma vez que o paralelismo de seus orbitais o favorece geometricamente. No entanto, estes não se encontram em qualquer orbital p anel aromático; apenas naqueles pertencentes aos carbonos nas posições orto e para em relação ao CHdois.
É por isso que os círculos azuis claros se destacam acima dos cinzas: neles se concentra a densidade negativa ou positiva do radical ou carbocátion, respectivamente..
Outros radicais
Deve ser mencionado que esta conjugação ou ressonância não pode ocorrer em carbonos sp.3 mais distante do anel aromático.
Por exemplo, o radical C6H5CHdoisCHdoisÉ muito mais instável porque o elétron desemparelhado não pode se conjugar com o anel quando o grupo CH intervémdois entre e com hibridização sp3. O mesmo vale para C6H5CHdoisCHdois+.
Reações
Resumindo: os hidrogênios benzílicos têm tendência a reagir, seja gerando um radical ou um carbocátion, que por sua vez acaba gerando o produto final da reação. Portanto, eles reagem por meio de um mecanismo SN.1.
Um exemplo é a bromação de tolueno sob radiação ultravioleta:
C6H5CH3 + 1 / 2Brdois => C6H5CHdoisBr
C6H5CHdoisBr + 1 / 2Brdois => C6H5CHBrdois
C6H5CHBrdois + 1 / 2Brdois => C6H5CBr3
De fato, nesta reação são produzidos radicais Br..
Por outro lado, o próprio grupo benzila reage para proteger os grupos OH ou NH.dois em uma simples reação de substituição. Assim, um álcool ROH pode ser 'benzilado' usando brometo de benzila e outros reagentes (KOH ou NaH):
ROH + BnBr => ROBn + HBr
ROBn é um éter benzílico, ao qual seu grupo OH inicial pode retornar se for submetido a um meio redutor. Este éter deve permanecer inalterado enquanto outras reações são realizadas no composto..
Referências
- Morrison, R.T. e Boyd, R. N. (1987). Quimica Organica. (5ª Edição). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Quimica Organica. (6ª Edição). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10ª edição). Wiley plus.
- Wikipedia. (2019). Grupo benzila. Recuperado de: en.wikipedia.org
- Dr. Donald L. Robertson. (5 de dezembro de 2010). Fenil ou benzil? Recuperado de: home.miracosta.edu
- Gamini Gunawardena. (2015, 12 de outubro). Carbocação Benzylic. Chemistry LibreTexts. Recuperado de: chem.libretexts.org



Ainda sem comentários