
Estrutura, propriedades, preparação, utilizações do azul de bromotimol
O azul de bromotimol É um corante sensível ao pH de seu ambiente e tem sido usado como indicador em muitas reações laboratoriais. Um indicador é um corante orgânico cuja cor depende da concentração do íon H.3OU+ ou o pH do meio. Pela cor que exibe, o indicador pode indicar a acidez ou basicidade da solução.
O azul de bromotimol possui escala de indicação ativa entre pH 6,0 e 7,6. A um pH do meio inferior a 6,5, mostra uma coloração amarela. Quando o pH do meio varia entre 6,5 e 7,6, adquire uma cor verde. Em pH superior a 7,6 sua cor é azul.

Esta característica torna este indicador muito útil, pois pode ser utilizado em uma escala de pH próxima da neutralidade; precisamente onde os processos fisiológicos ocorrem.
A ionização do azul de bromotimol em solução aquosa pode ser descrita da seguinte forma:
HIn (cor amarela) + HdoisOU <=> Dentro- (cor azul) + H3OU+
Quando o indicador é protonado (HIn) adquire uma cor amarela; enquanto que se o indicador desprotonado (Em-) fica azul.
Índice do artigo
- 1 Estrutura química
- 1,1 mudanças de pH
- 2 propriedades
- 2.1 Nome químico
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Aparência física
- 2.5 Característica química
- 2.6 Constante de dissociação iônica (Ka)
- 2.7 Faixa de indicação ativa
- 2.8 Densidade
- 2.9 Ponto de fusão
- 2.10 Ponto de ebulição
- 2.11 Solubilidade
- 2.12 Estabilidade
- 2.13 Absorção de luz
- 3 usos e aplicações
- 3.1 Em estudos metabólicos
- 3.2 Em obstetrícia
- 3.3 Outros usos
- 4 Preparação
- 5 referências
Estrutura química
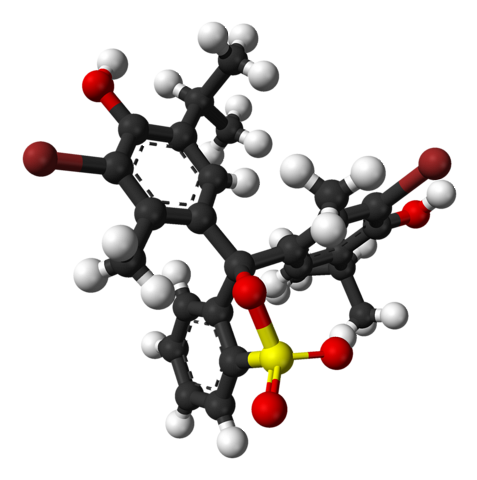
A imagem superior representa a estrutura do azul de bromotimol com um modelo de barra e esfera com pH inferior a 7,1. As barras marrons correspondem a átomos de bromo, dois no total.
Cada um dos três anéis aromáticos compõe, juntamente com os grupos metil, CH3, e tertbutilo, o grupo timol; e tendo vinculado um Br, surge daí o motivo pelo qual é denominado 'bromotimol'.
Na parte inferior é mostrado o grupo sulfonato, R-SO3-, com esferas vermelhas e uma amarela. Este grupo pode ser ligado através de um átomo de O ao carbono central que une os três anéis aromáticos.
Mudanças de PH
Embora essa estrutura molecular não mude radicalmente com o pH ácido ou básico, seus estados eletrônicos são alterados, refletidos por mudanças na cor das soluções..
Abaixo de pH 7, o indicador é de cor amarela e adota a estrutura da imagem; mas se o pH se tornar básico, os grupos -OH se desprotonam e uma ligação dupla C = O pode formar.
Como resultado, o sistema conjugado da molécula (o de todas as suas ligações duplas ressonantes) muda o suficiente para que os elétrons não mais absorvam os mesmos fótons, e a solução passa de amarelo para azulado..
Se, por outro lado, o pH estiver bem abaixo de 7, a cor do indicador muda de amarelo para vermelho. Aqui, a mudança no sistema conjugado é devido à protonação dos grupos -OH para -OHdois+. -
Tanto em ambientes ácidos quanto básicos, a molécula perde estabilidade, absorvendo fótons de menor energia para permitir as transições eletrônicas responsáveis pelas cores percebidas pelos espectadores..
E a cor verde da imagem principal? À medida que o pH se aproxima de 7,1, uma pequena porção das moléculas perde prótons, emitindo uma cor azul que, quando misturada com o amarelo, dá a cor verde..
Propriedades
Nome químico
Azul de bromotimol ou 3,3'-dibromotimolsulfonaftaleína.
Fórmula molecular
C27H28BrdoisOU5S.
Peso molecular
624.384 g / mol.
Aspecto físico
Pó sólido com uma cor que varia de rosa a roxo.
Característica química
Ele atua como um ácido fraco em solução. Quando protonado em meio ácido adquire cor amarela, em pH neutro passa a verde e quando desprotonado em pH alcalino passa a azul..
Constante de dissociação iônica (Ka)
7,9 x 10-8.
Faixa de indicação ativa
pH 6,0 a 7,6. Isso se deve à presença de átomos de bromo que atuam para extrair elétrons, e dois grupos moderados de doadores de elétrons (substituintes alquil).
Densidade
1,25 g / cm3.
Ponto de fusão
202 ºC (396 º F).
Ponto de ebulição
184,9 ºC.
Solubilidade
É pouco solúvel em água e óleo. Da mesma forma, é pouco solúvel em solventes apolares, como benzeno, tolueno e xileno, e praticamente insolúvel em éter de petróleo. É solúvel em soluções alcalinas aquosas e em álcool.
Estabilidade
É estável à temperatura ambiente e incompatível com agentes oxidantes fortes.
Absorção de luz
A forma protonada tem absorção máxima no comprimento de onda (λ) de 427 nm, transmitindo luz amarela em soluções ácidas e a forma desprotonada tem absorção máxima no comprimento de onda (λ) de 602 nm, transmitindo luz azul. Em pH alcalino.
Usos e aplicações
Em estudos metabólicos
O azul de bromotimol é usado em muitos processos em que o dióxido de carbono (COdois), com a consequente geração de ácido carbônico (HdoisCO3), que acidifica o meio; evidenciado por uma mudança na coloração do azul de bromotimol.
Se uma pessoa está fazendo exercício físico e está conectada a um tubo que, por sua vez, é conectado a um recipiente com uma solução de azul de bromotimol, será observado o seguinte fenômeno: como consequência do aumento da atividade física e do metabolismo, haverá um aumento na produção de COdois.
O COdois vai reagir com água, produzindo ácido carbônico, HdoisCO3, que posteriormente se dissocia liberando o íon H+ e acidificar o meio. Como consequência, o azul de bromotimol adquire uma coloração amarela, destacando a acidez do meio..
Em obstetrícia
O azul de bromotimol é usado em obstetrícia para mostrar a ruptura precoce das membranas. O líquido amniótico normalmente tem um pH superior a 7,7, então o azul de bromotimol ficará azul quando entrar em contato com o fluido que vaza do âmnio..
O pH vaginal é geralmente ácido, então o azul de bromotimol tem uma tonalidade amarela. A mudança em sua cor para azul destaca a presença de líquido amniótico na região vaginal.
Outros usos
O azul de bromotimol também tem aplicação nos seguintes equipamentos e funções:
-Sensores Ópticos
-Sistemas de detecção de combustão de gás
-Na fabricação de tintas, brinquedos, produtos de limpeza, detergentes e têxteis
-Sensores de frescor de alimentos
-Como alça para arroz fresco e velho
-Na detecção de microrganismos.
Também é usado em análises de crescimento bacteriano, drogas psicoativas e materiais dentários..
Preparação
100 mg de azul de bromotimol são dissolvidos em 100 mL de álcool diluído e filtrados se necessário. Também é preparado da seguinte forma: 50 mg de azul de bromotimol são dissolvidos em uma mistura de 4 mL de hidróxido de sódio 0,02 N e 20 mL de álcool, perfazendo 100 mL com água.
Referências
- Wikipedia. (2018). Azul de bromotimol. Recuperado de: en.wikipedia.org
- Foist L. (2018). Azul de bromotimol: definição, utilizações e fórmula. Estudar. Recuperado de: study.com
- The Science Company. (2018). Indicador de pH azul de bromotimol, 1 onça Recuperado de: sciencecompany.com
- Determinação espectrofotométrica do pK do indicador azul de bromotimol. Recuperado de: fch.upol.cz
- PubChem. (2018). Azul de bromotimol. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Azul de bromotimol. ChemSpider. Recuperado de: chemspider.com
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.



Ainda sem comentários