
Estrutura, propriedades, nomenclatura, riscos e usos do anisolo
O anisol ou metoxibenzeno é um composto orgânico que consiste em um éter aromático cuja fórmula química é C6H5OCH3. Seu estado físico é de um líquido incolor, que pode apresentar colorações amareladas. É facilmente reconhecido por seu odor característico de erva-doce.
É então um composto volátil e forças de coesão não muito altas; características típicas dos éteres leves, que são armazenados em pequenos recipientes selados. Especificamente, o anisol é o mais simples dos éteres alquilarílicos; isto é, aqueles com um componente aromático (Ar) e outro componente alquil (R), Ar-O-R.
Grupo C6H5- passa a denotar Ar, e -CH3 para R, tendo assim C6H5-O-CH3. O anel aromático e a presença de -OCH3 Como um grupo substituinte denominado metoxi, dá ao anisol uma nucleofilicidade superior à do benzeno e do nitrobenzeno. Portanto, serve como uma molécula intermediária para a síntese de compostos com atividade farmacológica..
Seu cheiro característico de erva-doce tem sido usado para adicionar anisol a produtos cosméticos e de higiene que exigem uma fragrância agradável..
Índice do artigo
- 1 Estrutura do anisole
- 1.1 momento dipolo
- 1.2 Cristais
- 2 propriedades
- 2.1 Aparência física
- 2.2 Odor
- 2.3 Sabor
- 2.4 Massa molecular
- 2,5 Densidade
- 2,6 Densidade de vapor
- 2.7 Ponto de fusão
- 2.8 Ponto de ebulição
- 2.9 Ponto de fulgor
- 2.10 Temperatura de autoignição
- 2,11 Viscosidade
- 2.12 Tensão superficial
- 2.13 Índice de refração
- 2.14 Solubilidade
- 2,15 nucleofilicidade
- 2,16 Reatividade
- 3 Nomenclatura
- 4 riscos
- 5 usos
- 5.1 Sínteses orgânicas
- 5.2 Fragrâncias
- 6 referências
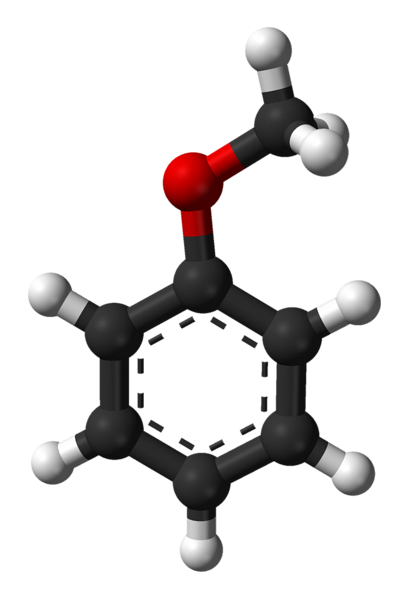
Estrutura anisole
A imagem superior mostra a estrutura molecular do anisolo usando um modelo de esferas e barras. Aprecia-se o anel aromático, cujos carbonos são spdois e, portanto, é plano, como uma folha hexagonal; e ligado a ele está o grupo metoxi, cujo carbono é sp3, e seus hidrogênios estão acima ou abaixo do plano do anel.
A importância do grupo -OCH3 na estrutura vai além de romper com a geometria plana da molécula: lhe confere polaridade e, conseqüentemente, a molécula apolar do benzeno adquire um momento de dipolo permanente..
Momento dipolo
Este momento de dipolo é devido ao átomo de oxigênio, que atrai as densidades de elétrons dos anéis aromáticos e metílicos. Graças a isso, as moléculas de anisolo podem interagir por meio de forças dipolo-dipolo; Porém, não tem possibilidade de formar ligações de hidrogênio, por ser um éter (ROR não possui H ligado ao oxigênio).
Seu alto ponto de ebulição (154ºC), certifica experimentalmente as fortes interações intermoleculares que governam seu líquido. Da mesma forma, as forças de dispersão de London estão presentes, dependendo da massa molecular e das interações π-π entre os próprios anéis.
Cristais
A estrutura do anisolo, entretanto, não permite que ele interaja com força suficiente para adotar um sólido à temperatura ambiente (mp = -37ºC). Isso também pode ser devido ao fato de que quando as distâncias intermoleculares são reduzidas, as repulsões eletrostáticas entre os elétrons dos anéis aromáticos vizinhos começam a ganhar muita força..
Portanto, e de acordo com estudos cristalográficos, as moléculas de anisol em cristais a uma temperatura de -173ºC não podem ser dispostas de forma que seus anéis fiquem voltados um para o outro; ou seja, seus centros aromáticos não estão alinhados um em cima do outro, mas sim um grupo -OCH3 está acima ou abaixo de um anel vizinho.
Propriedades
Aparência física
Líquido incolor, mas que pode ter leves tons de palha.
Odor
Cheira ligeiramente semelhante a sementes de anis.
Gosto
Doce; no entanto, é moderadamente tóxico, então este teste é perigoso.
Massa molecular
108,140 g / mol.
Densidade
0,995 g / mL.
Densidade do vapor
3,72 (em relação ao ar = 1).
Ponto de fusão
-37ºC.
Ponto de ebulição
154ºC.
ponto de ignição
125ºC (copo aberto).
Temperatura de autoignição
475ºC.
Viscosidade
0,778 cP a 30 ° C.
Tensão superficial
34,15 dinas / cm a 30ºC.
Indicador Refrativo
1,5179 a 20ºC.
Solubilidade
Fracamente solúvel em água (cerca de 1mg / mL). Em outros solventes, como acetona, éteres e álcoois, é no entanto muito solúvel.
Nucleofilicidade
O anel aromático do anisol é rico em elétrons. Isso ocorre porque o oxigênio, apesar de ser um átomo altamente eletronegativo, contribui com os elétrons de sua nuvem π para deslocalizá-los através do anel em inúmeras estruturas de ressonância. Consequentemente, mais elétrons viajam pelo sistema aromático e, portanto, sua nucleofilicidade aumenta..
O aumento da nucleofilicidade foi demonstrado experimentalmente pela comparação de sua reatividade, contra substituições eletrofílicas aromáticas, com a do benzeno. Assim, o notável efeito do grupo -OCH é evidenciado.3 nas propriedades químicas do composto.
Da mesma forma, deve-se notar que as substituições eletrofílicas ocorrem nas posições adjacentes (-orto) e opostas (-para) ao grupo metoxi; ou seja, é um diretor orto-para.
Reatividade
A nucleofilicidade do anel aromático do anisol já permite vislumbrar sua reatividade. As substituições podem ocorrer tanto no anel (favorecido por sua nucleofilicidade), ou no próprio grupo metoxi; no último, a ligação O-CH é quebrada3 para substituir o -CH3 por outro grupo alquil: O-alquilação.
Portanto, em um processo de alquilação, o anisol pode aceitar um grupo R (fragmento de outra molécula), substituindo um H em seu anel (C-alquilação), ou substituindo o CH3 de seu grupo metoxi. A imagem a seguir ilustra o que acaba de ser dito:
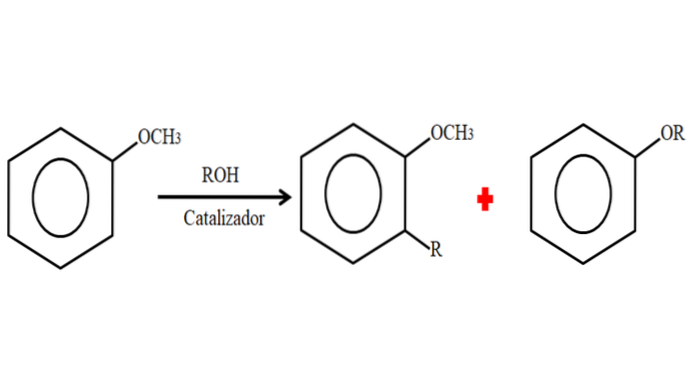
Na imagem, o grupo R está localizado na posição -orto, mas também pode estar na posição -para, oposto ao -OCH3. Quando a O-alquilação acontece, um novo éter com outro grupo -OR é obtido.
Nomenclatura
O nome 'anisole' é o mais conhecido e mais aceito, provavelmente derivado de seu cheiro de anis. No entanto, o nome 'metoxibenzeno' é bastante específico, uma vez que estabelece de uma vez qual é a estrutura e identidade deste éter aromático; este é o nome regido pela nomenclatura sistemática.
Outro nome menos usado, mas igualmente válido, é 'éter fenilmetílico', que é regido pela nomenclatura tradicional. Este é talvez o nome mais específico de todos, uma vez que indica diretamente quais são as duas porções estruturais do éter: fenil-O-metil, C6H5-O-CH3.
Riscos
Os estudos médicos ainda não foram capazes de demonstrar os possíveis efeitos mortais do anisol no corpo em baixas doses. No entanto, como quase todos os produtos químicos, causa irritação quando exposto por muito tempo e em concentrações moderadas na pele, garganta, pulmões e olhos..
Além disso, devido à nucleofilicidade de seu anel, uma parte dele é metabolizada e, portanto, é biodegradável. Na verdade, como resultado dessa propriedade, simulações mostraram que ele não pode se concentrar em ecossistemas aquosos, pois seus organismos o degradam primeiro; e, portanto, rios, lagos ou mares podem acumular anisola.
Nos solos, dada a sua volatilidade, evapora rapidamente e é levado pelas correntes de ar; sendo assim, tampouco afeta consideravelmente as massas vegetais ou plantações.
Por outro lado, atmosférico reage com os radicais livres e, portanto, não representa risco de contaminação do ar que respiramos..
Formulários
Sínteses orgânicas
Do anisol, outros derivados podem ser obtidos por substituição eletrofílica aromática. Isso permite que seja utilizado como intermediário para a síntese de fármacos, agrotóxicos e solventes, aos quais se deseja agregar suas características. As rotas sintéticas podem consistir principalmente em C-alquilação ou O-alquilação.
Fragrâncias
Além de ser utilizado para síntese orgânica, pode ser utilizado diretamente como aditivo para cremes, pomadas e perfumes, incorporando a tais produtos fragrâncias de erva-doce..
Referências
- Morrison, R. T. e Boyd, R, N. (1987). Quimica Organica. 5ª Edição. Editorial Addison-Wesley Interamericana.
- Carey F. A. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10ª edição). Wiley plus.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Anisole. Banco de dados PubChem, CID = 7519. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Recuperado de: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Alquilação em fase líquida de anisol e fenol catalisada por fosfato de nióbio. Jornal da Sociedade Brasileira de Química, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. e Goddard R. (2015). Anisol a 100 K: a primeira determinação da estrutura cristalina. Acta Crystallogr C Struct Chem., Agosto; 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Formulação Química. (2018). Metoxibenzeno Recuperado de: formulacionquimica.com


Ainda sem comentários