
Propriedades, estrutura, usos e exemplos de Alkynes
O alcinos Eles são hidrocarbonetos ou compostos orgânicos que possuem uma ligação tripla entre dois carbonos em suas estruturas. Esta ligação tripla (≡) é considerada um grupo funcional, pois representa um sítio ativo da molécula e, portanto, é responsável por sua reatividade.
Embora os alcinos não sejam muito diferentes dos alcanos ou alcenos, eles exibem maior acidez e polaridade devido à natureza de suas ligações. O termo preciso para descrever esta ligeira diferença é conhecido como insaturação.

Os alcanos são hidrocarbonetos saturados, enquanto os alcinos são os mais insaturados em relação à estrutura original. O que significa isto? Que um alcano H3C-CH3 (etano) pode ser desidrogenado em HdoisC = CHdois (eteno) e posteriormente para HC≡CH (etino, ou mais conhecido como acetileno).
Observe como, à medida que ligações adicionais são formadas entre os carbonos, o número de hidrogênios ligados a eles diminui. O carbono, devido às suas características eletrônicas, busca formar quatro ligações simples, portanto, quanto maior a insaturação, maior a tendência a reagir (com exceção dos compostos aromáticos).
Por outro lado, a ligação tripla é muito mais forte do que a ligação dupla (=) ou a ligação simples (-), mas com um alto custo de energia. Portanto, a maioria dos hidrocarbonetos (alcanos e alquenos) podem formar ligações triplas em temperaturas elevadas..
Como consequência das altas energias destes, e quando se rompem, liberam muito calor. Um exemplo desse fenômeno é visto quando o acetileno é queimado com oxigênio e o intenso calor da chama é usado para soldar ou derreter metais (imagem superior).
O acetileno é o alquino mais simples e menor de todos. Outros hidrocarbonetos podem ser expressos a partir de sua fórmula química substituindo o H por grupos alquil (RC≡CR '). O mesmo acontece no mundo da síntese orgânica por meio de um grande número de reações..
Este alcino é produzido a partir da reação do óxido de cálcio do calcário e do coque, uma matéria-prima que fornece os carbonos necessários em um forno elétrico:
CaO + 3C => CaCdois + CO
O CaCdois É carboneto de cálcio, um composto inorgânico que finalmente reage com a água para formar acetileno:
CaCdois + 2hdoisO => Ca (OH)dois + HC≡CH
Índice do artigo
- 1 Propriedades físicas e químicas dos alcinos
- 1.1 Polaridade
- 1.2 Acidez
- 2 Reatividade
- 2.1 Hidrogenação
- 2.2 Adicionando haletos de hidrogênio
- 2.3 Hidratação
- 2.4 Adicionando halogênios
- 2,5 Alquilação de acetileno
- 3 Estrutura química
- 3.1 Distância dos links e alcinos terminais
- 4 Nomenclatura
- 5 usos
- 5.1 Acetileno ou etino
- 5.2 Alcinos naturais
- 6 Exemplos de alcinos
- 6.1 Ácido tarírico
- 6.2 Histrionicotoxina
- 6,3 Cicutoxina
- 6,4 Capilina
- 6,5 Pargilina
- 7 referências
Propriedades físicas e químicas dos alcinos
Polaridade
A ligação tripla distingue alcinos de alcanos e alcenos. Os três tipos de hidrocarbonetos são apolares, insolúveis em água e ácidos muito fracos. No entanto, a eletronegatividade dos carbonos de ligação dupla e tripla é maior do que a dos carbonos simples..
Consequentemente, os carbonos adjacentes à ligação tripla produzem densidade de carga negativa por efeito indutivo. Por esta razão, onde as ligações C≡C ou C = C estão, haverá uma densidade de elétrons mais alta do que no resto do esqueleto de carbono. Como consequência, há um pequeno momento de dipolo em que as moléculas interagem por forças dipolo-dipolo..
Essas interações são muito fracas se seus momentos de dipolo forem comparados aos da molécula de água ou de qualquer álcool. Isso se reflete em suas propriedades físicas: os alcinos geralmente têm pontos de fusão e ebulição mais altos em comparação com seus hidrocarbonetos menos insaturados..
Da mesma forma, devido à sua baixa polaridade, eles são menos insolúveis em água, mas são solúveis em solventes orgânicos apolares, como o benzeno..
Acidez
Além disso, esta eletronegatividade faz com que o hidrogênio HC≡CR é mais ácido do que qualquer outro presente em outros hidrocarbonetos. Portanto, os alcinos são espécies mais ácidas do que os alcenos e muito mais ácidos do que os alcanos. No entanto, sua acidez ainda é desprezível quando comparada à dos ácidos carboxílicos..
Como os alcinos são ácidos muito fracos, eles reagem apenas com bases muito fortes, como a amida de sódio:
HC≡CR + NaNHdois => HC≡CNa + NH3
Desta reação é obtida uma solução de acetileto de sódio, matéria-prima para a síntese de outros alcinos..
Reatividade
A reatividade dos alcinos é explicada pela adição de pequenas moléculas à sua ligação tripla, diminuindo sua insaturação. Podem ser moléculas de hidrogênio, haletos de hidrogênio, água ou halogênios..
Hidrogenação
A pequena molécula de Hdois é muito evasivo e rápido, portanto, para aumentar as chances de eles serem adicionados à ligação tripla dos alcinos, catalisadores devem ser usados.
Geralmente são metais (Pd, Pt, Rh ou Ni) finamente divididos para aumentar a área de superfície; e, assim, o contato entre hidrogênio e alcino:
RC≡CR '+ 2Hdois => RCHdoisCHdoisR '
O resultado é que o hidrogênio é "ancorado" aos carbonos quebrando uma ligação, e assim por diante até produzir o alcano correspondente, RCHdoisCHdoisR '. Isso não apenas satura o hidrocarboneto inicial, mas também modifica sua estrutura molecular..
Adicionando haletos de hidrogênio
Aqui, a molécula inorgânica HX é adicionada, onde X pode ser qualquer um dos halogênios (F, Cl, Br ou I):
RC≡CR '+ HX => RCH = CXR'
Hidratação
A hidratação dos alcinos ocorre quando eles adicionam uma molécula de água para formar um aldeído ou uma cetona:
RC≡CR '+ HdoisO => RCHdoisCOR '
Se R 'for um H, é um aldeído; se for um alquil, então é uma cetona. Na reação, um composto conhecido como enol (RCH = C (OH) R ') é formado como um intermediário..
Este sofre uma conversão da forma enol (C-OH) para a forma cetônica (C = O) em um equilíbrio denominado tautomerização.
Adicionando halogênios
E com relação às adições, as moléculas diatômicas dos halogênios (Xdois= Fdois, Cldois, Brdois ouvidois):
RC≡CR '+ 2Xdois => RCXdois-CXdoisR '
Alquilação de acetileno
Outros alcinos podem ser preparados a partir da solução de acetileto de sódio usando um haleto de alquila:
HC≡CNa + RX => HC≡CR + NaX
Por exemplo, se fosse iodeto de metila, o alcino resultante seria:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 é a dica, também conhecida como metiloacetileno.
Estrutura química
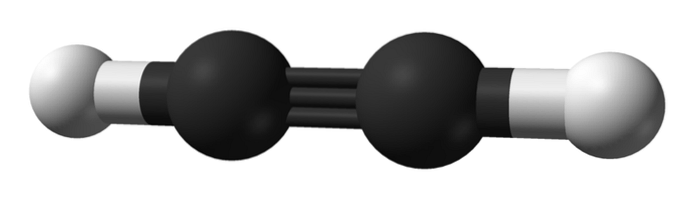
Qual é a estrutura dos alcinos? Uma molécula de acetileno é mostrada na imagem superior. A partir dele, a geometria linear da ligação C enlaceC pode ser claramente observada.
Portanto, onde há uma ligação tripla, a estrutura da molécula deve ser linear. Esta é outra das diferenças notáveis entre eles e o resto dos hidrocarbonetos.
Alcanos são geralmente representados como ziguezagues, porque eles têm hibridização sp3 e seus links estão separados por 109º. Eles são na verdade uma cadeia de tetraedros covalentemente ligados. Enquanto os alcenos são planos por hibridização spdois de seus carbonos, mais especificamente formando um plano trigonal com ligações separadas por 120º.
Nos alcinos a hibridização orbital é sp, ou seja, possuem caráter 50% s e caráter 50% p. Existem dois orbitais sp híbridos que se ligam a átomos de H em acetileno ou a grupos alquil em alcinos..
A distância entre os dois H ou R é de 180º, além do fato de que só assim os orbitais p puros dos carbonos podem formar a ligação tripla. Por esta razão, a ligação -C≡C- é linear. Olhando para a estrutura de qualquer molécula, o -C≡C- se destaca nas regiões onde o esqueleto é muito linear.
Distância dos links e alcinos terminais
Os carbonos na ligação tripla estão mais próximos do que na ligação dupla ou simples. Em outras palavras, C≡C é mais curto do que C = C e C-C. Como consequência, a ligação é mais forte porque as duas ligações π ajudam a estabilizar a ligação σ simples..
Se a ligação tripla estiver no final de uma cadeia, é um alcino terminal. Portanto, a fórmula do referido composto deve ser HC≡CR, onde H destaca o final ou início da cadeia.
Se, pelo contrário, for uma ligação tripla interna, a fórmula é RC≡CR ', onde R e R' são os lados direito e esquerdo da cadeia.
Nomenclatura
Como os alcinos são nomeados de acordo com as regras ditadas pela IUPAC? Da mesma forma que alcanos e alcenos foram nomeados. Para fazer isso, o sufixo -ano ou -eno é alterado para o sufixo -ino.
Por exemplo: o HC≡CCH3 é denominado propino, pois possui três carbonos, como o propano (CH3CHdoisCH3) O HC≡CCHdoisCH3 é 1-butino, que é um alcino terminal. Mas no caso do CH3C≡CCH3 é 2-butino, e neste a ligação tripla não é terminal, mas interna.
O CH3C≡CCHdoisCHdois(CH3)dois é 5-metil-2-hexino. Os carbonos são contados do lado mais próximo da ligação tripla.
Outro tipo de alcinos são cicloalquinos. Para eles, basta substituir o sufixo -ano por -ino do cicloalcano correspondente. Assim, o ciclopropano que possui uma ligação tripla é denominado como ciclopropino (que não existe).
Quando há duas ligações triplas, o prefixo di- é adicionado ao nome. Exemplos são HC3C-C3H, diacetileno ou propadino; e para HC≡C-C-C≡H, butadiino.
Formulários
Acetileno ou etino
O menor dos alcinos engrossa o número possível de usos para esses hidrocarbonetos. A partir dele, por meio de alquilações, outros compostos orgânicos podem ser sintetizados. Da mesma forma, sofre reações oxidativas para obtenção de etanol, ácido acético, ácido acrílico, entre outros..
Outro de seus usos consiste em fornecer a fonte de calor para excitar os elétrons dos átomos; mais especificamente de cátions metálicos em determinações de emissão-absorção atômica, uma técnica espectroscópica amplamente utilizada.
Alcinos naturais
Os únicos métodos existentes para preparar alcinos não são apenas sintéticos ou com aplicação de calor na ausência de oxigênio, mas também biológicos..
Estes usam enzimas chamadas acetilenases, que pode desidrogenar uma ligação dupla. Graças a isso, muitas fontes naturais de alcinos são obtidas.
Como resultado disso, venenos, antídotos, medicamentos ou qualquer outro composto que forneça algum benefício podem ser extraídos dessas fontes; especialmente quando se trata de saúde. As alternativas são muitas ao modificar suas estruturas originais e tê-las como suporte para novos alcinos..
Exemplos de alcinos
Até agora, vários exemplos de alcinos foram mencionados. No entanto, alguns vêm de fontes muito específicas ou têm estruturas moleculares particulares: são poliacetilenos.
Isso significa que pode haver mais de uma ligação tripla que faz parte de uma estrutura muito grande, e não apenas uma cadeia de carbono simples..
Ácido tarírico

O ácido tarírico vem de uma planta localizada na Guatemala chamada Picramnia tariri. É extraído especificamente do óleo de suas sementes.
Em sua estrutura molecular, pode-se observar uma única ligação tripla que separa uma cauda apolar de uma cabeça polar; portanto, pode ser considerado uma molécula anfipática.
Histrionicotoxina
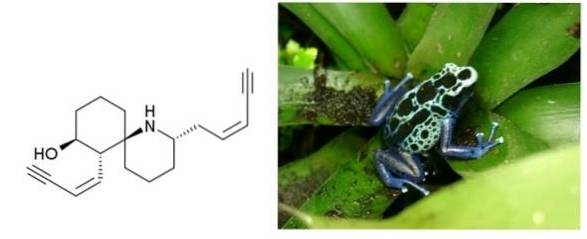
em en.wikipedia [domínio público], do Wikimedia Commons
A histrionicotoxina é um veneno secretado pela pele de rãs que habitam a Colômbia, o Brasil e outros países da América Latina. Possui duas ligações triplas conjugadas a uma ligação dupla. Ambos são terminais e separados por um anel de seis carbonos e uma amina cíclica..
Cicutoxina
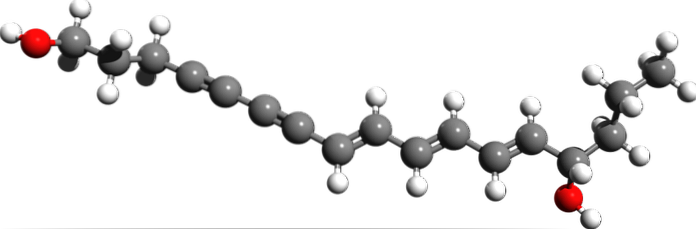
Da estrutura molecular da Cicutoxina, onde estão as ligações triplas? Se as ligações duplas são planas, como visto à direita, e as ligações simples são tetraédricas, como nas extremidades, as triplas são lineares e estão na inclinação (\).
Este composto consiste em uma neurotoxina encontrada principalmente na planta aquática cicuta..
Capillina
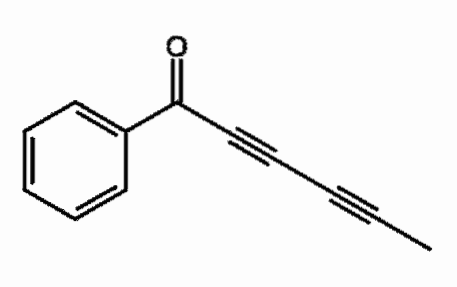
É um alcino presente no óleo essencial da artemísia que é utilizado como agente antifúngico. Podem ser observadas duas ligações triplas consecutivas, mais corretamente conjugadas.
Que significa? Essas ligações triplas ressoam por toda a cadeia de carbono e envolve a abertura da ligação dupla C = O para C-O-.
Pargilina
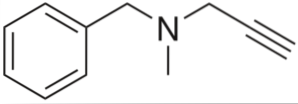
É um alcino com atividade anti-hipertensiva. Analisando sua estrutura por partes, temos: um grupo benzila à esquerda, uma amina terciária no meio e um propinila à direita; ou seja, um grupo terminal de propino.
Referências
- Francis A. Carey. Quimica Organica. Ácidos carboxílicos. (sexta edição, pp. 368-397). Mc Graw Hill.
- Brennan, John. (10 de março de 2018). Exemplos de Alkynes. Ciência. Retirado de: sciencing.com
- BYJU'S. (2018). Vínculo Triplo em Alkynes. Retirado de: byjus.com
- Enciclopédia de exemplos (2017). Alkynes. Recuperado de: examples.co
- Kevin A. Boudreaux. Alkynes. Retirado de: angelo.edu
- Robert C. Neuman, Jr. Alkenes e Alkynes. [PDF]. Retirado de: chem.ucr.edu


Ainda sem comentários