
Base, preparação e uso de ágar Baird Parker
O Ágar Baird Parker É um meio de cultura sólido, seletivo e diferencial. Foi criado em 1962 para a detecção e contagem de estafilococos coagulase positivos (Staphylococcus aureus).
É composto por hidrolisado de caseína pancreática, extrato de carne, extrato de levedura, cloreto de lítio, glicina, piruvato de sódio, telurito de potássio, ágar e emulsão de gema de ovo..
Baird Parker Agar é baseado na capacidade do S. aureus para reduzir a telurita e produzir lecitinase. Ambas as propriedades geram uma colônia com características específicas para esta espécie. Portanto, é altamente eficaz na detecção desse microrganismo..
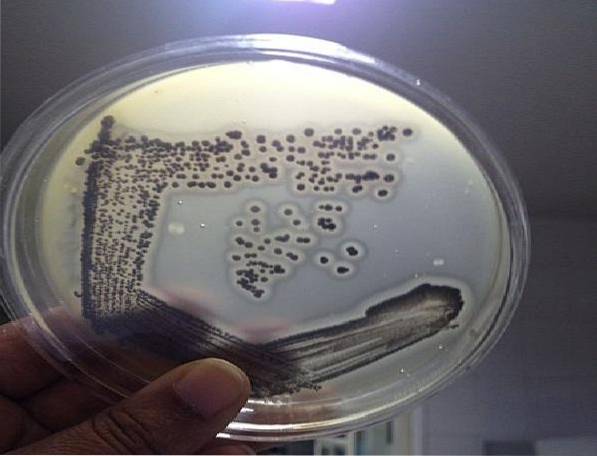
As colônias típicas de S. aureus São pretos ou cinza escuro, com uma borda incolor e um halo claro que os envolve, diferenciando-os de outros microrganismos. Este patógeno pode ser encontrado em amostras clínicas, águas, cosméticos e alimentos crus ou cozidos..
O seu diagnóstico ou detecção é de extrema importância, devido à variedade de patologias que produz, como intoxicações alimentares, síndrome da pele escaldada, síndrome do choque tóxico, abscessos, meningite, septicemia, endocardite, entre outras..
Índice do artigo
- 1 justificativa
- 1.1 Poder nutritivo
- 1.2 Seletiva
- 1.3 Diferencial
- 2 Preparação
- 2.1 Emulsão de gema de ovo
- 2.2 Telurito de potássio 1% p / v
- 2.3 Preparação do meio de cultura
- 3 Use
- 3.1 Amostras clínicas
- 3.2 Amostras de alimentos
- 3.3 Amostras de água
- 4 Controle de qualidade
- 5 recomendações
- 6 referências
Base
Poder nutritivo
Hidrolisado de caseína pancreática, extrato de carne e extrato de levedura são as fontes de nutrientes, vitaminas e minerais necessários para o desenvolvimento microbiano geral, enquanto o piruvato e a glicina são compostos que promovem o crescimento específico de Staphylococcus aureus.
Seletivo
O Baird Parker Agar é seletivo porque contém substâncias que inibem o crescimento da flora que o acompanha, ao mesmo tempo que promove o desenvolvimento de S. aureus. Os compostos inibidores são cloreto de lítio e telurito de potássio..
Diferencial
Este meio torna possível diferenciar S. aureus do resto dos estafilococos coagulase negativos. S. aureus tem a capacidade de reduzir telurito a telúrio preto metálico livre, formando colônias pretas ou cinza escuro.
Da mesma forma, a gema de ovo fornece os substratos para demonstrar a presença das enzimas lecitinase e lipase.. S. aureus é lecitinase positivo e, portanto, um halo claro será observado ao redor da colônia, indicando que a lecitina foi hidrolisada.
Nesse sentido, o aparecimento neste ágar de colônias pretas brilhantes ou cinza escuro com um halo claro ao redor indica a presença de S. aureus.
Se uma zona de precipitação se formar, isso é indicativo de atividade da lipase. Algumas cepas de S. aureus eles são lipase positivos e outros negativos.
No caso de o S. aureus Se a lipase for positiva, uma área opaca será observada ao redor da colônia preta ou cinza escura, e então um halo claro devido à ação da lecitinase.
Colônias de bactérias que não S. aureus capaz de crescer neste meio desenvolverá colônias incolores ou marrons, sem halo circundante.
As colônias pretas atípicas também podem ser vistas com ou sem uma borda incolor, mas sem um halo de luz. Estas colônias não devem ser levadas em consideração, não correspondem a S. aureus.
Preparação
Emulsão de gema de ovo
Pegue um ovo de galinha fresco, lave bem e coloque em álcool 70% por 2 a 3 horas. O ovo é então aberto assepticamente e a clara é cuidadosamente separada da gema. Posteriormente, 50 ml da gema são retirados e misturados com 50 ml de solução fisiológica estéril..
Telurito de potássio 1% w / v
Algumas casas comerciais vendem telurito de potássio a 1% pronto para uso. É adicionado ao meio antes que o meio solidifique.
Para preparar esta solução em laboratório, 1,0 g de telurito de potássio é pesado e dissolvido em uma parte de água. Posteriormente, a quantidade de água é completada até atingir 100 ml. A solução deve ser esterilizada pelo método de filtração.
Preparação do meio de cultura
Pesar 60 g do meio desidratado e dissolver em 940 ml de água destilada. Deixe a mistura descansar por aproximadamente 5 a 10 minutos.
Aplique calor mexendo o meio frequentemente para melhorar o processo de dissolução. Deixe ferver por um minuto. Esterilizar na autoclave a 121 ° C por 15 minutos.
Deixar repousar até atingir a temperatura de 45 ° C e adicionar 50 ml da emulsão de gema de ovo e 10 ml de telurito a 1%. Misture bem e despeje 15-20 ml em placas de Petri estéreis..
Deixe solidificar, arrume invertido em plaquetas e guarde na geladeira até o uso.
O pH final do meio preparado deve ser 6,8 ± 0,2.
Antes de semear uma amostra, espere a placa atingir a temperatura ambiente. Semeie placas por faixa ou semeadura superficial com espátula Drigalski.
A cor do meio desidratado é castanho claro e a cor do meio preparado é âmbar claro.
Usar
Amostras clínicas
As amostras clínicas são semeadas diretamente, descarregando-se parte do material em uma das extremidades da placa, e daí é semeado por exaustão. Incubar por 24 a 48 horas a 35-37 ° C.
Amostras de alimentos
Pesar 10 g da amostra de alimento e homogeneizar em 90 ml de água peptonada 0,1%, a partir daí são preparadas diluições se necessário. Inocular as placas em triplicado com 0,3 ml das soluções preparadas e semear na superfície com uma espátula Drigalski. Incubar por 24 a 48 horas a 35-37 ° C.
Esta metodologia permite contar as colônias típicas obtidas e é ideal quando a presença de S. aureus acima de 10 CFU por gr / ml de amostra.
Se a quantidade de S. aureus Se for pequeno ou com muita flora acompanhante, sugere-se enriquecer a amostra em caldo de tripticase soja com NaCl 10% e piruvato de sódio 1%. Isso vai favorecer o crescimento de S. aureus e irá inibir o desenvolvimento da flora que o acompanha. Tubos turvos são semeados em ágar Baird Parker..
Amostras de água
Em um sistema de filtração a vácuo esterilizado, 100 ml da água do estudo são filtrados e, subsequentemente, a membrana microporosa de 0,4 mícron é removida com uma pinça estéril e colocada em uma placa Baird Parker. Incubar por 24 a 48 horas a 35-37 ° C. Esta técnica permite a contagem de colônias típicas de S. aureus.
Controle de qualidade
As cepas conhecidas podem ser usadas para avaliar a qualidade do Baird Parker Agar, como Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 ou Proteus mirabilis ATCC 43071.
No caso de cepas de S. aureus ATCC é conhecido por reduzir a telurita, e eles são positivos para lipase e lecitinase. Portanto, deve haver um desenvolvimento satisfatório e crescer colônias convexas com um centro preto e uma borda incolor, com um halo opaco e um halo externo claro..
Por sua vez, S. epidermidis baixo desenvolvimento é esperado neste meio, com colônias cinza-acastanhadas a pretas, sem halo claro.
A fim de E. coli Y P. mirabilis espera-se que seja total ou parcialmente inibido. Em caso de crescimento, colônias marrons se desenvolverão sem área opaca ou halo claro.
recomendações
-O meio não deve ser aquecido após adicionar o telurito e a gema de ovo.
-O preparo da emulsão de gema de ovo e sua adição no meio é uma etapa muito vulnerável à contaminação. É preciso ter cuidado.
-Se houver colônias típicas de S. aureus deve ser corroborado pela montagem de um teste de coagulase na referida cepa.
-Se houver resultados duvidosos com a coagulase, outros testes de confirmação devem ser montados.
-Tome cuidado para não confundir a presença de colônias típicas de S. aureus com colônias pretas atípicas.
Referências
- Colaboradores da Wikipedia. Agar Baird-Parker. Wikipédia, a enciclopédia livre. 15 de março de 2017, 19:36 UTC. Disponível em: wikipedia.org/ Acessado em 18 de fevereiro de 2019.
- Laboratórios BD. Baird Parker Agar. 2006. Disponível em: bd.com
- Britannia Laboratories. Base de ágar Baird Parker. 2015. Disponível em: britanialab.com
- Laboratórios Francisco Soria Melguizo. 2009. Baird Parker Agar. Disponível em: http://f-soria.es/Inform
- Britannia Laboratories. Telurito de potássio. 2015. Disponível em: britanialab.com
- Alarcón-Lavín M, Oyarzo C, Escudero C, Cerda-Leal F, Valenzuela F. Carrying of Staphylococcus aureus enterotoxigênico tipo A, em esfregaços nasofaríngeos em manipuladores de alimentos. Rev Med Chile 2017; 145: 1559-1564
- Venezuelan Standard Covenin 1292-89. (1989). Comida. Isolamento e contagem Staphylococcus aureus. Disponível em:sencamer.gob.ve


Ainda sem comentários