
Histórico de iodo, propriedades, estrutura, obtenção, riscos, usos
O iodo É um elemento reativo não metálico que pertence ao grupo 17 da tabela periódica (halogênios) e é representado pelo símbolo químico I. Em essência, é um elemento bastante popular, desde a água iodada até o hormônio tirosina.
No estado sólido, o iodo é cinza escuro com brilho metálico (imagem inferior), capaz de se sublimar para produzir um vapor violeta que, ao condensar em superfície fria, deixa um resíduo escuro. Numerosos e atraentes têm sido os experimentos para demonstrar essas características.

Este elemento foi isolado pela primeira vez por Bernard Curtois no ano de 1811, ao obter compostos que serviram de matéria-prima para a fabricação do salitre. No entanto, Curtois não identificou o iodo como elemento, mérito compartilhado por Joseph Gay-Lussac e Humphry Davy. Gay-Lussac identificou o elemento como “iodo”, termo que veio da palavra grega “ioides” com a qual a cor violeta era designada..
O iodo elementar, como os outros halogênios, é uma molécula diatômica, composta de dois átomos de iodo ligados por uma ligação covalente. A interação de Van der Waals entre as moléculas de iodo é a mais forte entre os halogênios. Isso explica por que o iodo é o halogênio com os maiores pontos de fusão e ebulição. Além disso, é o menos reativo dos halogênios e o de menor eletronegatividade..
O iodo é um elemento essencial que precisa ser ingerido, pois é necessário para o crescimento corporal; desenvolvimento cerebral e mental; metabolismo em geral, etc., recomendando uma ingestão diária de 110 µg / dia.
A deficiência de iodo no estado fetal de uma pessoa está associada ao aparecimento de cretinismo, uma condição caracterizada pela desaceleração do crescimento corporal; bem como desenvolvimento mental e intelectual insuficiente, estrabismo, etc..
Já a deficiência de iodo em qualquer idade do indivíduo está associada ao aparecimento de bócio, caracterizado por hipertrofia da tireoide. O bócio é uma doença endêmica, pois está confinado a certas áreas geográficas com características nutricionais próprias.
Índice do artigo
- 1 história
- 1.1 Descoberta
- 1.2 Emergência do nome
- 1.3 Usos históricos
- 2 Propriedades físicas e químicas
- 2.1 Aparência
- 2.2 Peso atômico padrão
- 2.3 Número atômico (Z)
- 2.4 Ponto de fusão
- 2,5 ponto de ebulição
- 2.6 Densidade
- 2.7 Solubilidade
- 2.8 Odor
- 2,9 Coeficiente de partição octanol / água
- 2.10 Decomposição
- 2,11 Viscosidade
- 2,12 ponto triplo
- 2.13 Ponto Crítico
- 2.14 Calor de fusão
- 2.15 Calor de vaporização
- 2.16 Capacidade de calor molar
- 2.17 Pressão de vapor
- 2,18 números de oxidação
- 2,19 Eletronegatividade
- 2.20 Energia de ionização
- 2.21 Condutividade térmica
- 2.22 Resistividade elétrica
- 2.23 Ordem magnética
- 2.24 Reatividade
- 3 Estrutura e configuração eletrônica
- 3.1 - Átomo de iodo e suas ligações
- 3.2 - Cristais
- 3.3 - Fases
- 4 Onde encontrar e obter
- 4.1 O caliche
- 4.2 A salmoura
- 5 papel biológico
- 5.1 - Dieta recomendada
- 5.2 - Hormônios da tireóide
- 5.3 - Deficiência
- 6 riscos
- 7 usos
- 7.1 Médicos
- 7.2 Reações e ação catalítica
- 7.3 Fotografia e ótica
- 7.4 Outros usos
- 8 referências
História
Descoberta
O iodo foi descoberto pelo químico francês Bernard Curtois, no ano de 1811, enquanto trabalhava com seu pai na produção de salitre, necessitando de carbonato de sódio para isso..
Este composto foi isolado de algas marinhas coletadas nas costas da Normandia e da Bretanha. Para tanto, as algas foram queimadas e as cinzas lavadas com água, destruindo os resíduos resultantes com a adição de ácido sulfúrico..
Em uma ocasião, talvez por um erro fortuito, Curtois adicionou um excesso de ácido sulfúrico e formou-se um vapor púrpura que se cristalizou nas superfícies frias, estabelecendo-se como cristais escuros. Curtois suspeitou que estava na presença de um novo elemento e chamou-o de "Substância X".
Curtois descobriu que esta substância quando misturada com amônia formou um sólido marrom (triiodeto de nitrogênio) que explodiu ao menor contato.
No entanto, Curtois teve limitações para continuar sua pesquisa e decidiu dar amostras de sua substância a Charles Desormes, Nicolas Clément, Joseph Gay-Lussac e André-Marie Ampère, a fim de obter a colaboração deles..
Surgimento do nome
Em novembro de 1813, Desormes e Clément tornaram pública a descoberta de Curtois. Em dezembro do mesmo ano, Gay-Lussac apontou que a nova substância poderia ser um novo elemento, sugerindo o nome "iodo" da palavra grega "ioides", designada por violeta..
Sir Humphry Davy, que recebeu uma parte da amostra dada a Ampère por Curtois, fez experiências com a amostra e notou uma semelhança com o cloro. Em dezembro de 1813, a Royal Society of London estava envolvida na identificação de um novo elemento.
Embora tenha surgido uma discussão entre Gay-Lussac e Davy sobre a identificação do iodo, os dois reconheceram que Curtois foi o primeiro a isolá-lo. Em 1839, Curtois finalmente recebeu o Prêmio Montyn da Royal Academy of Sciences em reconhecimento ao isolamento do iodo..
Usos históricos
Em 1839, Louis Daguerre deu ao iodo seu primeiro uso comercial, inventando um método de produção de imagens fotográficas chamado daguerreótipos, em finas folhas de metal..
Em 1905, o patologista americano David Marine, investigou a deficiência de iodo em certas doenças e recomendou sua ingestão.
Propriedades físicas e químicas
Aparência

Cinza escuro sólido com brilho metálico. Quando sublimado, seus vapores são de cor roxa (imagem superior).
Peso atômico padrão
126,904 u
Número atômico (Z)
53
Ponto de fusão
113,7 ºC
Ponto de ebulição
184,3 ºC
Densidade
Temperatura ambiente: 4,933 g / cm3
Solubilidade
Dissolve-se em água para produzir soluções castanhas com concentração de 0,03% a 20 ºC..
Esta solubilidade é consideravelmente aumentada se houver íons de iodeto previamente dissolvidos, uma vez que um equilíbrio é estabelecido entre o I- e eudois para formar a espécie aniônica I3-, que solvata melhor do que o iodo.
Em solventes orgânicos, como clorofórmio, tetracloreto de carbono e dissulfeto de carbono, o iodo se dissolve dando uma tonalidade roxa. Da mesma forma, ele se dissolve em compostos nitrogenados, como piridina, quinolina e amônia, para formar uma solução marrom, novamente.
A diferença nas colorações reside no fato de o iodo ser dissolvido como moléculas solvatadas Idois, ou como complexos de transferência de carga; os últimos aparecem quando são solventes polares (água entre eles), que se comportam como bases de Lewis, doando elétrons ao iodo.
Odor
Pungente, irritante e característico. Limite de odor: 90 mg / m3 e limite de odor irritante: 20 mg / m3.
Coeficiente de partição octanol / água
Log P = 2,49
Decomposição
Quando aquecido até a decomposição, emite uma fumaça de iodeto de hidrogênio e vários compostos de iodeto..
Viscosidade
2,27 cP a 116 ºC
Ponto Triplo
386,65 K e 121 kPa
Ponto crítico
819 K e 11,7 MPa
Calor de fusão
15,52 kJ / mol
Calor da vaporização
41,57 kJ / mol
Capacidade de calor molar
54,44 J / (mol K)
Pressão de vapor
O iodo tem uma pressão de vapor moderada e quando o recipiente é aberto sublima lentamente em um vapor violeta, irritando os olhos, nariz e garganta..
Números de oxidação
Os números de oxidação do iodo são: -1 (eu-), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) e +7 (I7+) Em todos os sais de iodeto, como no caso do KI, o iodo tem um número de oxidação de -1, pois neles temos o ânion I-.
O iodo adquire números de oxidação positivos quando é combinado com elementos mais eletronegativos do que ele; por exemplo, em seus óxidos (IdoisOU5 e eu4OU9) ou compostos interhalogenados (I-F, I-Cl e I-Br).
Eletro-negatividade
2,66 na escala de Pauling
Energia de ionização
Primeiro: 1.008,4 kJ / mol
Segundo: 1.845 kJ / mol
Terceiro: 3.180 KJ / mol
Condutividade térmica
0,449 W / (m K)
Resistividade elétrica
1,39 107 Ω · m a 0 ºC
Ordem magnética
Diamagnético
Reatividade
O iodo combina-se com a maioria dos metais para formar iodetos e também com elementos não metálicos, como fósforo e outros halogênios. O íon iodeto é um forte agente redutor, que libera um elétron espontaneamente. A oxidação do iodeto produz uma tonalidade acastanhada de iodo.
O iodo, em contraste com o iodeto, é um agente oxidante fraco; mais fraco que bromo, cloro e flúor.
O iodo com número de oxidação +1 pode se combinar com outros halogênios com número de oxidação -1, para dar haletos de iodo; por exemplo: brometo de iodo, IBr. Da mesma forma, ele se combina com o hidrogênio para dar origem ao iodeto de hidrogênio, que após se dissolver em água é chamado de ácido iodídrico..
O ácido hidroiódico é um ácido muito forte, capaz de formar iodetos por reação com metais ou seus óxidos, hidróxidos e carbonatos. O iodo tem um estado de oxidação +5 em ácido iódico (HIO3), que é desidratado para produzir pentóxido de iodo (IdoisOU5).
Estrutura e configuração eletrônica
- Átomo de iodo e suas ligações

O iodo em seu estado fundamental consiste em um átomo que possui sete elétrons de valência, apenas um para poder completar seu octeto e se tornar isoeletrônico com o gás nobre xenônio. Esses sete elétrons estão dispostos em seus orbitais 5s e 5p de acordo com sua configuração eletrônica:
[Kr] 4d10 5sdois 5 p5
Portanto, os átomos I mostram uma forte tendência de se ligar covalentemente, de modo que cada um individualmente tem oito elétrons em sua camada mais externa. Assim, dois átomos de I se aproximam e formam a ligação I-I, que define a molécula diatômica Idois (imagem superior); unidade molecular de iodo em seus três estados físicos em condições normais.
A imagem mostra a molécula Idois representado por um modelo de preenchimento espacial. Não é apenas uma molécula diatômica, mas também homonuclear e apolar; então suas interações intermoleculares (Idois - eudois) são governados pelas forças de dispersão de Londres, que são diretamente proporcionais à sua massa molecular e ao tamanho dos átomos.
Esta ligação I-I, no entanto, é mais fraca em comparação com os outros halogênios (F-F, Cl-Cl e Br-Br). Isso é teoricamente devido à fraca sobreposição de seus orbitais híbridos sp3.
- Cristais
A massa molecular de Idois permite que suas forças dispersivas sejam direcionais e fortes o suficiente para estabelecer um cristal ortorrômbico à pressão ambiente. Seu alto conteúdo de elétrons faz com que a luz promova transições de energia infinitas, o que faz com que os cristais de iodo manchem de preto.
No entanto, quando o iodo é sublimado, seus vapores apresentam uma coloração violeta. Isso já é indicativo de uma transição mais específica dentro dos orbitais moleculares do Idois (aqueles com maior energia ou anti-link).
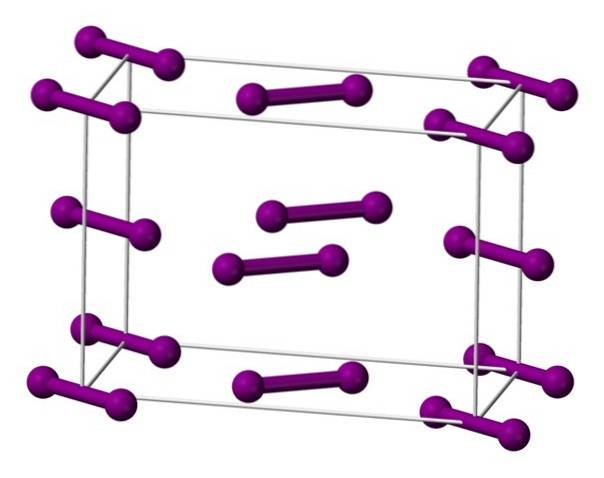
Moléculas I são mostradas acimadois, representado por um modelo de esferas e barras, dispostas dentro da célula unitária ortorrômbica.
Pode-se observar que existem duas camadas: a inferior com cinco moléculas e a do meio com quatro. Observe também que uma molécula de iodo fica na base da célula. O vidro é construído distribuindo periodicamente essas camadas em todas as três dimensões..
Viajando na direção paralela às ligações I-I, verifica-se que os orbitais do iodo se sobrepõem para gerar uma banda de condução, o que torna esse elemento um semicondutor; no entanto, sua capacidade de conduzir eletricidade desaparece se a direção perpendicular às camadas for seguida.
Distâncias de link
O link I-I parece ter se expandido; e de fato é, já que o comprimento de sua ligação aumenta de 266 pm (estado gasoso), para 272 pm (estado sólido).
Isso pode ser devido ao fato de que no gás as moléculas Idois eles estão muito distantes, suas forças intermoleculares sendo quase desprezíveis; enquanto no sólido, essas forças (I-I - I-I) tornam-se tangíveis, atraindo os átomos de iodo de duas moléculas vizinhas entre si e, consequentemente, encurtando a distância intermolecular (ou interatômica, vista de outra forma).
Então, quando o cristal de iodo sublima, a ligação I-I se contrai na fase gasosa, uma vez que as moléculas vizinhas não mais exercem a mesma força atrativa (dispersiva) em seus arredores. E também, logicamente, a distância que eudois - eudois aumenta.
- Fases
Foi mencionado anteriormente que a ligação I-I é mais fraca em comparação com os outros halogênios. Na fase gasosa a uma temperatura de 575 ºC, 1% das moléculas Idois eles se dividem em átomos I individuais. Há tanta energia de calor que apenas dois I's se juntam novamente e se separam, e assim por diante.
Da mesma forma, essa quebra de ligação pode ocorrer se uma pressão enorme for aplicada aos cristais de iodo. Ao comprimi-lo demais (sob pressão centenas de milhares de vezes maior que a atmosférica), as moléculas Idois são reorganizados como uma fase monoatômica I, e o iodo é, então, dito que exibe características metálicas.
No entanto, existem outras fases cristalinas, tais como: ortorrômbica centrada no corpo (fase II), tetragonal centrada no corpo (fase III) e cúbica centrada na face (fase IV).
Onde encontrar e obter
O iodo tem uma relação de peso, em relação à crosta terrestre, de 0,46 ppm, ocupando o 61º lugar em abundância. Minerais de iodeto são escassos e os depósitos de iodo comercialmente exploráveis são iodatos..
Minerais de iodo são encontrados em rochas ígneas com concentração de 0,02 mg / kg a 1,2 mg / kg e em rochas magmáticas com concentração de 0,02 mg a 1,9 mg / kg. Também pode ser encontrado no xisto Kimmeridge, com concentração de 17 mg / kg de peso.
Além disso, os minerais de iodo são encontrados em rochas de fosfato com uma concentração variando de 0,8 a 130 mg / kg. A água do mar tem uma concentração de iodo que varia de 0,1 a 18 µg / L. Algas, esponjas e ostras eram antigamente as principais fontes de iodo.
Atualmente, no entanto, as principais fontes são caliche, depósitos de nitrato de sódio no deserto de Atacama (Chile) e salmouras, principalmente do campo de gás japonês em Minami Kanto, a leste de Tóquio, e o campo de gás Anadarko. Bacia em Oklahoma (EUA).
O caliche
O iodo é extraído do caliche na forma de iodato e é tratado com bissulfito de sódio para reduzi-lo a iodeto. A solução é então feita reagir com iodato recém-extraído para facilitar sua filtração. Caliche foi a principal fonte de iodo no século XIX e no início do século XX..
A salmoura
Após a purificação, a salmoura é tratada com ácido sulfúrico, que produz iodeto..
Esta solução de iodeto é subsequentemente reagida com cloro para produzir uma solução diluída de iodo, que é evaporada por uma corrente de ar que é desviada para uma torre de absorção de dióxido de enxofre, produzindo a seguinte reação:
eudois + 2 hdoisO + SOdois => 2 HI + HdoisSW4
Posteriormente, o gás iodeto de hidrogênio reage com o cloro para liberar o iodo em estado gasoso:
2 HI + Cldois => Eudois + 2 HCl
E, finalmente, o iodo é filtrado, purificado e embalado para uso..
Papel biológico
- Dieta recomendada
O iodo é um elemento essencial, visto que intervém em inúmeras funções nos seres vivos, especialmente conhecidas no homem. A única maneira de o iodo entrar no homem é através da comida que ele come.
A dieta recomendada para o iodo varia com a idade. Assim, uma criança de 6 meses requer uma ingestão de 110 µg / dia; mas, a partir dos 14 anos, a dieta recomendada é de 150 µg / dia. Além disso, afirma-se que a ingestão de iodo não deve exceder 1.100 µg / dia.
- Hormônios da tireóide
O hormônio estimulador da tireoide (TSH) é secretado pela glândula pituitária e estimula a captação de iodo pelos folículos da tireoide. O iodo é transportado para os folículos da tireoide, conhecidos como coloides, onde se liga ao aminoácido tirosina para formar monoiodotirosina e diiodotirosina..
No colóide folicular, uma molécula de monoiodotironina se combina com uma molécula de diiodotironina para formar uma molécula chamada triiodotironina (T3) Por outro lado, duas moléculas de diiodotirosina podem se juntar, formando tetraiodotironina (T4) O t3 e o T4 são chamados de hormônios da tireoide.
Hormônios T3 e T4 são secretados no plasma, onde se ligam às proteínas plasmáticas; incluindo proteína transportadora de hormônio da tireóide (TBG). A maioria dos hormônios da tireoide são transportados no plasma como T4.
No entanto, a forma ativa dos hormônios da tireoide é T3, então o T4 nos "órgãos brancos" dos hormônios da tireoide, sofre desiodação e se transforma em T3 para exercer sua ação hormonal.
Edição de efeitos
Os efeitos da ação dos hormônios tireoidianos são múltiplos, podendo-se destacar: aumento do metabolismo e da síntese protéica; promoção do crescimento corporal e desenvolvimento do cérebro; aumento da pressão arterial e frequência cardíaca, etc..
- Deficiência
A deficiência de iodo e, portanto, dos hormônios tireoidianos, conhecida como hipotireoidismo, tem inúmeras consequências que são influenciadas pela idade da pessoa.
Se a deficiência de iodo ocorre durante o estado fetal de uma pessoa, a consequência mais relevante é o cretinismo. Esta condição é caracterizada por sinais como função mental prejudicada, desenvolvimento físico retardado, estrabismo e maturação sexual retardada..
Uma deficiência de iodo pode induzir o bócio, independentemente da idade em que a deficiência ocorre. O bócio é um superdesenvolvimento da tireoide, causado pela estimulação excessiva da glândula pelo hormônio TSH, liberado pela hipófise como resultado da deficiência de iodo..
O tamanho excessivo da tireoide (bócio) pode comprimir a traqueia, limitando a passagem de ar por ela. Além disso, pode causar danos aos nervos laríngeos que podem levar à rouquidão..
Riscos
A intoxicação por ingestão excessiva de iodo pode causar queimaduras na boca, garganta e febre. Também dor abdominal, náusea, vômito, diarreia, pulso fraco e coma.
O excesso de iodo produz alguns dos sintomas observados na deficiência: há uma inibição da síntese dos hormônios tireoidianos, o que aumenta a liberação de TSH, o que resulta em uma hipertrofia da tireoide; ou seja, um bócio.
Existem estudos que indicam que a ingestão excessiva de iodo pode causar tireoidite e câncer papilar de tireoide. Além disso, a ingestão excessiva de iodo pode interagir com os medicamentos, limitando sua ação..
A ingestão excessiva de iodo em conjunto com medicamentos antitireoidianos, como o metimazol, usado para tratar o hipertireoidismo, pode ter um efeito aditivo e causar hipotireoidismo..
Os inibidores da enzima de conversão da angiotensina (ECA), como o benazepril, são usados para tratar a hipertensão. Tomar muito iodeto de potássio aumenta o risco de hipercalemia e hipertensão.
Formulários
Doutores
O iodo atua como desinfetante para a pele ou feridas. Possui ação antimicrobiana quase instantânea, penetrando no interior dos microrganismos e interagindo com aminoácidos sulfurados, nucleotídeos e ácidos graxos, o que causa morte celular.
Ele exerce sua ação antiviral principalmente sobre os vírus cobertos, postulando que ataca as proteínas da superfície dos vírus cobertos..
O iodeto de potássio na forma de solução concentrada é utilizado no tratamento da tireotoxicose. Também é usado para controlar os efeitos da radiação de 131I, bloqueando a ligação do isótopo radioativo à tireóide.
O iodo é usado no tratamento da ceratite dendrítica. Para fazer isso, a córnea é exposta a vapores de água saturados com iodo, perdendo temporariamente o epitélio da córnea; mas há uma recuperação completa em dois ou três dias.
Além disso, o iodo tem efeitos benéficos no tratamento da fibrose cística da mama humana. Da mesma forma, foi apontado que o 131Eu poderia ser um tratamento opcional para câncer de tireoide.
Reações e ação catalítica
O iodo é usado para detectar a presença de amido, dando uma coloração azul. A reação do iodo com o amido também é usada para detectar a presença de notas falsas impressas em papel contendo amido..
O tetraiodomercurato de potássio (II), também conhecido como reagente de Nessler, é usado na detecção de amônia. Da mesma forma, uma solução alcalina de iodo é usada no teste de iodofórmio, para mostrar a presença de metil cetonas..
Os iodetos inorgânicos são usados na purificação de metais, como titânio, zircônio, háfnio e tório. Em uma etapa do processo, os tetraiodetos desses metais devem ser formados.
O iodo serve como um estabilizador para breu, óleo e outros produtos de madeira.
O iodo é usado como um catalisador nas reações de síntese orgânica de metilação, isomerização e desidrogenação. Enquanto isso, o ácido iodídrico é usado como um catalisador para a produção de ácido acético nos processos Monsanto e Cativa..
O iodo atua como um catalisador na condensação e alquilação de aminas aromáticas, bem como em processos de sulfatação e sulfanação, e para a produção de borrachas sintéticas.
Fotografia e ótica
O iodeto de prata é um componente essencial do filme fotográfico tradicional. O iodo é usado na fabricação de instrumentos eletrônicos, como prismas de cristal único, instrumentos ópticos de polarização e vidro capaz de transmitir raios infravermelhos..
Outros usos
O iodo é usado na fabricação de pesticidas, corantes de anilina e ftaleína. Além disso, é utilizado na síntese de corantes, sendo um agente extintor de fumaça. E, por fim, o iodeto de prata serve como núcleo de condensação do vapor d'água nas nuvens, para causar chuva..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Stuart Ira Fox. (2003). Fisiologia humana. Primeira edição. Editar. McGraw-Hill Interamericana
- Wikipedia. (2019). Iodo. Recuperado de: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi e Onoda Mitsuko. (2003). Estrutura modulada do iodo sólido durante sua dissociação molecular sob alta pressão. Nature volume 423, páginas 971-974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Transições de fase estrutural do iodo em alta pressão. Instituto de Física, Academia Sinica, Pequim. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider e Karl Christe. (26 de agosto de 2019). Iodo. Encyclopædia Britannica. Recuperado de: britannica.com
- Dr. Doug Stewart. (2019). Fatos sobre o elemento iodo. Chemicool. Recuperado de: chemicool.com
- Centro Nacional de Informações sobre Biotecnologia. (2019). Iodo. Banco de dados PubChem. CID = 807. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarcadores de nutrição para revisão de desenvolvimento de iodo. The Journal of Nutrition, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Iodo. Química explicada. Recuperado de: chemicalexplained.com
- Traci Pedersen. (19 de abril de 2017). Fatos sobre o iodo. Recuperado de: livescience.com
- Megan Ware, RDN, LD. (30 de maio de 2017). Tudo o que você precisa saber sobre o iodo. Recuperado de: medicalnewstoday.com
- Instituto Nacional de Saúde. (9 de julho de 2019). Iodo. Recuperado de: ods.od.nih.gov

Ainda sem comentários