
Fórmula do óxido perclórico (Cl2O7), propriedades, riscos

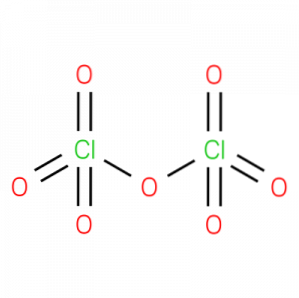
O óxido perclórico, também chamado de óxido de cloro (VII), anidrido perclórico ou dicloro heptoxido,é um composto químico inorgânico com a fórmula CldoisO7. Sua estrutura é apresentada na figura 1.
É um dos óxidos de cloro mais estáveis e reage com a água para produzir ácido perclórico: CldoisOU7 + HdoisO D 2HClO4.
O composto é obtido por desidratação cuidadosa de ácido perclórico com pentóxido de fósforo a -10 ° C.
2HClO4 + PdoisOU5 ”CldoisOU7 + 2HPO3
O composto é destilado para separá-lo do ácido metafosfórico com considerável cautela, dada sua natureza explosiva. Também pode ser formado por iluminação em misturas de cloro e ozônio.
Propriedades físicas e químicas do óxido perclórico
O óxido de cloro (VII) é um líquido incolor, volátil e oleoso. Seu peso molecular é de 182,9 g / mol, sua densidade é de 1900 kg / m3 e seus pontos de fusão e ebulição são -91,57 ºC e 82 ºC, respectivamente..
É espontaneamente explosivo no impacto ou em contato com a chama e especialmente na presença de seus produtos de decomposição..
O heptoxido de cloro dissolve-se em tetracloreto de carbono à temperatura ambiente e reage com a água para formar ácido perclórico. Explosões em contato com iodo.
Em condições normais, é mais estável, embora com menor poder oxidante que os demais óxidos de cloro. Por exemplo, não ataca enxofre, fósforo ou papel quando está frio.
O dicloro heptoxido é um óxido fortemente ácido e em solução forma um equilíbrio com o ácido perclórico. Forma percloratos na presença de hidróxidos de metais alcalinos.
Sua decomposição térmica é produzida pela dissociação monomolecular de trióxido de cloro e radical
Reatividade e perigos
O óxido perclórico é um composto instável. Decompõe-se lentamente no armazenamento, com a produção de produtos de decomposição coloridos que são óxidos de cloro mais baixos.
É espontaneamente explosivo, principalmente na presença de seus produtos de decomposição, incompatível com agentes redutores, ácidos e bases fortes..
Embora seja o óxido de cloro mais estável, CldoisOU7 É um oxidante forte, bem como um explosivo que pode ser extinto com chama ou choque mecânico, ou por contato com o iodo..
No entanto, é menos oxidante do que os outros óxidos de cloro e não ataca o enxofre, o fósforo ou o papel quando frio. Tem os mesmos efeitos no corpo humano que o cloro elementar e requer as mesmas precauções
A ingestão causa queimaduras graves na boca, esôfago e estômago. O vapor é muito tóxico por inalação.
Em caso de contato com os olhos, verifique se está usando lentes de contato e remova-as imediatamente. Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada. Pomada para os olhos não deve ser usada.
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas mãos e corpo. Coloque a vítima sob um chuveiro de emergência.
Se o produto químico se acumular na pele exposta da vítima, como nas mãos, a pele contaminada deve ser lavada com cuidado e cuidado com água corrente e sabão não abrasivo..
Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de usá-la novamente.
Em caso de inalação, a vítima deve ser deixada repousar em área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível..
Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata. Se a vítima tiver dificuldade para respirar, deve-se administrar oxigênio.
Se a vítima não estiver respirando, a ressuscitação boca a boca é realizada. Sempre tendo em mente que pode ser perigoso para a pessoa que está prestando socorro fazer reanimação boca a boca quando o material inalado for tóxico, infeccioso ou corrosivo..
Em todos os casos, procure atendimento médico imediatamente.
Formulários
O óxido perclórico não tem aplicações práticas. Pode ser usado como um agente oxidante ou para a produção de ácido perclórico, mas sua natureza explosiva torna difícil o manuseio.
O dicloro heptoxido pode ser utilizado como reagente para a produção de percloratos ou para o estudo de diferentes reações..
No trabalho de Kurt Baum, as reações de óxido perclórico com olefinas (Baum, 1976), álcoois (Kurt Baum, Reactions of dichlorine heptoxide with alcohols, 1974), iodetos de alquila e perclorato de acila com éster (Kurt Baum, 1975) obtendo halogenações e oxidações.
No caso dos álcoois, produz percloratos de alquila por reação com álcoois simples, como etilenoglicol, 1,4-butadienol, 2,2,2-trifluoroetanol, 2,2-dinitropropanol. Reage com 2-propanol para dar perclorato de isopropila. 2-hexanol e 3-hexanol dão percloratos não tratados e suas respectivas cetonas.
O propeno reage com dicloroheptosídeo em tetracloreto de carbono para dar perclorato de isopropila (32%) e 1-cloro, 2-propilperclorato (17%). O composto reage com cis-buteno para dar perclorato de 3-clorobutila (30%) e 3-ceto, perclorato de 2-butila (7%).
O dicloroheptoxido reage com aminas primárias e secundárias em solução de tetracloreto de carbono para dar N-percloratos:
2 RNH2 + Cl2O7 → 2 RNHClO3 + H2O
2 R2NH + Cl2O7 → 2 R2NClO3 + H2O
Ele também reage com alquenos para dar percloratos de alquila. Por exemplo, ele reage com propeno em solução de tetracloreto de carbono para produzir perclorato de isopropila e perclorato de 1-cloro-2-propila (Beard & Baum, 1974)..
Referências
- Baum, K. (1976). Reações de heptoxido de dicloro com olefinas. Org. Chem. 41 (9) , 1663-1665.
- Beard, C. D., & Baum, K. ... (1974). Reações de heptoóxido de dicloro com aminas. Journal of the American Chemical Society. 96 (10), 3237-3239.
- Egon Wiberg, N. W. (2001). Química Inorgânica. Academic Press: Londres.
- EMBL-EBI. (25 de abril de 2009). heptaóxido de dicloro. Obtido em ChEBI: ebi.ac.uk.
- Kurt Baum, C. D. (1974). Reações de heptoxido de dicloro com álcoois. Am. Chem. Soc., 96 (10), 3233-3237.
- Kurt Baum, C. D. (1975). Reações de heptoxido de dicloro e de percloratos de acila com éteres. Org. Chem., 40 (1) , 81-85.
- Kurt Baum, C. D. (1975). Reações de heptoxido de dicloro e de hipohalitos com iodetos de alquil. Org. Chem., 40 (17), 2536-2537.
- Royal Society of Chemistry. (2015). Heptoxido de dicloro. Obtido em chemspider: chemspider.com.



Ainda sem comentários