
Estrutura, propriedades e usos do óxido de prata (Ag2O)
O óxido de prata é um composto inorgânico cuja fórmula química é AgdoisO. A força que une seus átomos é inteiramente iônica por natureza; portanto, consiste em um sólido iônico onde há uma proporção de dois cátions Ag+ interagindo eletrostaticamente com um ânion Odois-.
O ânion óxido, Odois-, Resulta da interação dos átomos de prata da superfície com o oxigênio do meio ambiente. da mesma forma que o ferro e muitos outros metais. Em vez de avermelhar e se desfazer em ferrugem, uma peça ou joia de prata fica preta, característica do óxido de prata..

Por exemplo, na imagem acima você pode ver uma xícara de prata oxidada. Observe sua superfície enegrecida, embora ainda retenha algum brilho ornamental; razão pela qual até objetos de prata oxidada podem ser considerados atraentes o suficiente para usos decorativos.
As propriedades do óxido de prata são tais que, à primeira vista, não corroem a superfície do metal original. É formado à temperatura ambiente pelo simples contato com o oxigênio do ar; e ainda mais interessante, pode se decompor em altas temperaturas (acima de 200 ° C).
Isso significa que, se o vidro da foto fosse agarrado e o calor de uma chama intensa fosse aplicado a ele, ele recuperaria seu brilho prateado. Portanto, sua formação é um processo termodinamicamente reversível..
O óxido de prata também possui outras propriedades e, além de sua fórmula simples AgdoisOu abrange organizações estruturais complexas e uma rica variedade de sólidos. No entanto, o AgdoisOu talvez seja, ao lado do AgdoisOU3, o mais representativo dos óxidos de prata.
Índice do artigo
- 1 Estrutura do óxido de prata
- 1.1 Alterações com o número de valência
- 2 Propriedades físicas e químicas
- 2.1 Peso molecular
- 2.2 Aparência
- 2.3 Densidade
- 2.4 Ponto de fusão
- 2,5 Kps
- 2.6 Solubilidade
- 2.7 Caráter covalente
- 2.8 Decomposição
- 3 Nomenclatura
- 3.1 Valências I e III
- 3.2 Nomenclatura sistemática para óxidos de prata complexos
- 4 usos
- 5 referências
Estrutura do óxido de prata
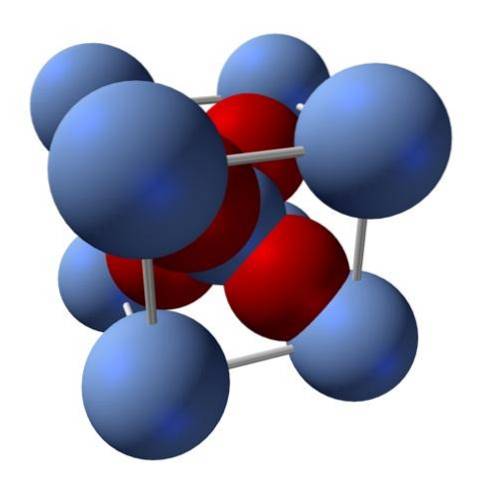
Como está sua estrutura? Como mencionado no início: é um sólido iônico. Por esta razão, não pode haver ligações covalentes Ag - O nem Ag = O em sua estrutura; já que, se houvesse algum, as propriedades desse óxido mudariam drasticamente. É, então, Ag íons+ Eudois- em uma proporção de 2: 1 e experimentando atração eletrostática.
A estrutura do óxido de prata é conseqüentemente determinada pela maneira como as forças iônicas organizam os íons Ag no espaço.+ Eudois-.
Na imagem acima, por exemplo, há uma célula unitária para um sistema de cristal cúbico: os cátions Ag+ são as esferas prata-azul, e o Odois- as esferas avermelhadas.
Se o número de esferas for contado, verá que existem, a olho nu, nove azuis prateadas e quatro vermelhas. No entanto, apenas os fragmentos das esferas contidas no cubo são considerados; contando estes, sendo frações das esferas totais, a proporção de 2: 1 para Ag deve ser atendidadoisOU.
Repetindo a unidade estrutural do tetraedro AgO4 cercado por quatro outros Ag+, todo o sólido preto é construído (evitando as lacunas ou irregularidades que esses arranjos cristalinos podem ter).
Mudanças com o número de valência
Focando agora não no tetraedro AgO4 mas na linha AgOAg (observe os vértices do cubo superior), verá que o sólido de óxido de prata consiste, de outra perspectiva, em múltiplas camadas de íons dispostas linearmente (embora inclinadas). Tudo isso como resultado da geometria "molecular" em torno de Ag+.
Isso foi corroborado por vários estudos de sua estrutura iônica..
A prata trabalha predominantemente com valência +1, pois ao perder um elétron sua configuração eletrônica resultante é [Kr] 4d10, que é muito estável. Outras valências, como Agdois+ e Ag3+ eles são menos estáveis, pois perdem elétrons de orbitais d quase completos.
O íon Ag3+, no entanto, é relativamente menos instável em comparação com Agdois+. Na verdade, pode coexistir na companhia de Ag+ enriquecendo quimicamente a estrutura.
Sua configuração eletrônica é [Kr] 4d8, com elétrons desemparelhados de tal forma que dá alguma estabilidade.
Ao contrário das geometrias lineares em torno dos íons Ag+, verificou-se que os íons de Ag3+ é um plano quadrado. Portanto, um óxido de prata com íons Ag3+ consistiria em camadas compostas por quadrados de AgO4 (não tetraedros) ligados eletrostaticamente por linhas AgOAg; tal é o caso de Ag4OU4 ou AgdoisO ∙ AgdoisOU3 com estrutura monoclínica.
Propriedades físicas e químicas

Raspar a superfície da xícara de prata na imagem principal resultaria em um sólido, que não é apenas preto, mas também tem tons de marrom ou marrom (imagem superior). Algumas de suas propriedades físicas e químicas relatadas no momento são as seguintes:
Peso molecular
231,735 g / mol
Aparência
Sólido marrom-escuro em forma de pó (observe que, apesar de ser um sólido iônico, ele não tem uma aparência cristalina). É inodoro e misturado com água confere-lhe um sabor metálico
Densidade
7,14 g / mL.
Ponto de fusão
277-300 ° C Certamente ele se derrete em prata sólida; ou seja, provavelmente se decompõe antes de formar o óxido líquido.
Kps
1,52 ∙ 10-8 em água a 20 ° C. É, portanto, um composto dificilmente solúvel em água.
Solubilidade
Se você olhar atentamente para a imagem de sua estrutura, verá que as esferas de Agdois+ Eudois- eles não diferem quase em tamanho. Isso resulta em que apenas pequenas moléculas podem passar pelo interior da rede cristalina, tornando-a insolúvel em quase todos os solventes; exceto para aqueles onde reage, como bases e ácidos.
Caráter covalente
Embora o óxido de prata tenha sido repetidamente considerado um composto iônico, certas propriedades, como seu baixo ponto de fusão, contradizem essa afirmação..
Certamente, a consideração do caráter covalente não destrói o que foi explicado para sua estrutura, uma vez que bastaria adicionar na estrutura de Ag.doisOu um modelo de esferas e barras para indicar ligações covalentes.
Da mesma forma, os tetraedros e planos quadrados AgO4, bem como as linhas AgOAg, eles seriam ligados por ligações covalentes (ou covalentes iônicos).
Com isso em mente, o AgdoisOu seria realmente um polímero. No entanto, recomenda-se considerá-lo como um sólido iônico com caráter covalente (cuja natureza da ligação ainda é um desafio hoje).
Decomposição
A princípio foi mencionado que sua formação é termodinamicamente reversível, por isso absorve calor para retornar ao seu estado metálico. Tudo isso pode ser expresso por duas equações químicas para tais reações:
4Ag (s) + Odois(g) => 2AgdoisO (s) + Q
2AgdoisO (s) + Q => 4Ag (s) + Odois(g)
Onde Q representa o calor na equação. Isso explica por que o fogo que queima a superfície da taça de prata oxidada retorna seu brilho prateado..
Portanto, é difícil supor que existe AgdoisO (l) uma vez que se decomporia instantaneamente com o calor; A menos que a pressão seja elevada demais para obter o referido líquido marrom preto.
Nomenclatura
Quando a possibilidade de íons Ag foi introduzidadois+ e Ag3+ além do Ag comum e predominante+, o termo 'óxido de prata' começa a parecer insuficiente para se referir a AgdoisOU.
Isso ocorre porque o íon Ag+ é mais abundante do que os outros, então o Ag é tomadodoisOu como o único óxido; o que não é correto de forma alguma.
Se Agdois+ como é praticamente inexistente dada a sua instabilidade, teremos apenas os íons com valências +1 e +3; ou seja, Ag (I) e Ag (III).
Valencias I e III
Como Ag (I) é aquele com a menor valência, ele é nomeado adicionando o sufixo -oso ao seu nome argentum. Assim, o AgdoisOu é: óxido de prata ou, de acordo com a nomenclatura sistemática, monóxido de placa.
Se Ag (III) for completamente ignorado, sua nomenclatura tradicional deve ser: óxido de prata em vez de óxido de prata.
Por outro lado, sendo Ag (III) a valência mais alta, o sufixo -ico é adicionado ao seu nome. Assim, o AgdoisOU3 é: óxido de prata (2 íons Ag3+ com três O'sdois-) Além disso, seu nome de acordo com a nomenclatura sistemática seria: trióxido de diplata.
Se a estrutura de AgdoisOU3, pode-se presumir que é o produto da oxidação pelo ozônio, OU3, em vez de oxigênio. Portanto, seu caráter covalente deve ser maior, pois é um composto covalente com ligações Ag-O-O-O-Ag ou Ag-O.3-Ag.
Nomenclatura sistemática para óxidos de prata complexos
The AgO, também escrito como Ag4OU4 ou AgdoisO ∙ AgdoisOU3, É um óxido de prata (I, III), pois tem valências +1 e +3. Seu nome de acordo com a nomenclatura sistemática seria: tetraóxido de prata.
Essa nomenclatura é de grande ajuda quando se trata de outros óxidos de prata estequiometricamente complexos. Por exemplo, suponha que os dois sólidos 2AgdoisO ∙ AgdoisOU3 e AgdoisO ∙ 3AgdoisOU3.
Escrever o primeiro mais apropriadamente seria: Ag6OU5 (contando e adicionando os átomos de Ag e O). Seu nome seria pentóxido hexaplate. Observe que este óxido tem uma composição de prata menos rica do que AgdoisOu (6: 5 < 2:1).
Enquanto escrevia o segundo sólido de outra maneira, seria: Ag8OU10. Seu nome seria decaóxido de octa-prata (com uma proporção de 8:10 ou 4: 5). Este hipotético óxido de prata seria "muito oxidado".
Formulários
Os estudos em busca de novos e sofisticados usos para o óxido de prata continuam até hoje. Alguns de seus usos estão listados abaixo:
-Ele se dissolve em amônia, nitrato de amônio e água para formar o reagente de Tollens. Este reagente é uma ferramenta útil na análise qualitativa em laboratórios de química orgânica. Permite determinar a presença de aldeídos em uma amostra, com a formação de um "espelho de prata" no tubo de ensaio como resposta positiva..
-Junto com o zinco metálico, forma as baterias principais de óxido de zinco-prata. Este é talvez um de seus usos mais comuns e domésticos.
-Serve como purificador de gás, absorvendo por exemplo COdois. Quando aquecido, ele libera gases presos e pode ser reutilizado várias vezes.
-Devido às propriedades antimicrobianas da prata, seu óxido é útil em estudos de bioanálise e purificação de solo..
-É um agente oxidante suave, capaz de oxidar aldeídos em ácidos carboxílicos. Também é utilizado na reação de Hofmann (de aminas terciárias) e participa de outras reações orgânicas, seja como reagente ou como catalisador..
Referências
- Bergstresser M. (2018). Óxido de prata: fórmula, decomposição e formação. Estudar. Recuperado de: study.com
- Autores e editores dos volumes III / 17E-17F-41C. (s.f.). Óxidos de prata (Ag (x) O (y)) estrutura de cristal, parâmetros de rede. (Dados Numéricos e Relações Funcionais em Ciência e Tecnologia), vol 41C. Springer, Berlim, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). O impacto potencial do tratamento de energia do biocampo nas propriedades físicas e térmicas do pó de óxido de prata. Revista Internacional de Ciência e Engenharia Biomédica. Vol. 3, No. 5, pp. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Decomposição do óxido de prata. University of Oregon. Recuperado de: chemdemos.uoregon.edu
- Flint, Deyanda. (24 de abril de 2014). Usos de baterias de óxido de prata. Ciência. Recuperado de: sciencing.com
- Salman Montasir E. (2016). Estudo de algumas propriedades ópticas do óxido de prata (Ag2o) usando espectrofotômetro UVVisible. [PDF]. Recuperado de: iosrjournals.org
- Bard Allen J. (1985). Potenciais padrão em solução aquosa. Marcel Dekker. Recuperado de: books.google.co.ve



Ainda sem comentários