
Estrutura, propriedades, usos, riscos do óxido de bário (BaO)

O óxido de bário É um sólido inorgânico formado por um átomo de bário (Ba) e um átomo de oxigênio (O). Sua fórmula química é BaO. É um sólido cristalino branco e higroscópico, ou seja, absorve a umidade do ar, mas ao fazê-lo reage com ela..
A rápida reação do óxido de bário com a água faz com que seja utilizado em laboratórios de análises químicas para secar, ou seja, retirar a água dos solventes orgânicos, que são compostos líquidos que servem para dissolver outras substâncias..

O BaO se comporta como uma base forte, portanto reage com muitos tipos de ácidos. Por exemplo, reage facilmente com dióxido de carbono COdois do ar para formar carbonato de bário BaCO3.
É usado na fabricação de polímeros para cabos de força e como ingrediente para resinas para selar orifícios em dentes que foram curados.
O óxido de bário (BaO) também é utilizado na indústria cerâmica, tanto para revesti-la com esmalte quanto para sua fabricação. Também é utilizado em misturas de cimento para aumentar a resistência à compressão do produto final..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades físicas
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Solubilidade
- 4 propriedades químicas
- 5 riscos
- 6 Obtendo
- 7 usos
- 7.1 Como dessecante para solventes orgânicos
- 7.2 Em lâmpadas de descarga
- 7.3 Na fabricação de cerâmica
- 7.4 Na preparação de misturas de cimento
- 7.5 Em várias aplicações
- 8 referências
Estrutura
Óxido de bário BaO é composto de um bátiodois+ e um ânion O de oxigêniodois-.
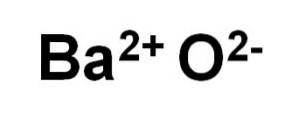
Em seus cristais, o BaO forma redes iônicas cúbicas (em forma de cubo) do tipo cloreto de sódio.
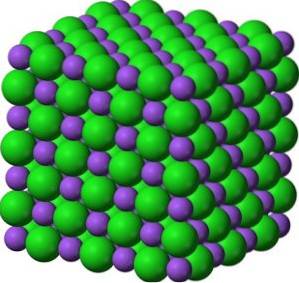
A configuração eletrônica do íon bário é: [Xe] 6s0 já que perdeu os dois elétrons da camada 6s. Esta configuração é muito estável.
Nomenclatura
-Óxido de bário
-Monóxido de bário
Propriedades físicas
Estado físico
Sólido cristalino branco-amarelado.
Peso molecular
153,33 g / mol
Ponto de fusão
1923 ºC
Ponto de ebulição
Aproximadamente 2.000 ºC.
Densidade
5,72 g / cm3
Solubilidade
Ligeiramente solúvel em água: 3,8 g / 100 mL a 20 ºC.
Propriedades quimicas
O óxido de bário BaO reage rapidamente com a água, liberando calor e formando uma solução corrosiva de hidróxido de bário Ba (OH)dois, qual é o hidróxido mais solúvel entre os hidróxidos de metais alcalino-terrosos.
BaO + HdoisO → Ba (OH)dois
BaO é uma base forte. Reage exotermicamente (ou seja, com evolução de calor) com todos os tipos de ácidos.
Com COdois BaO reage para formar carbonato de bário BaCO3.
BaO + COdois → BaCO3
O BaO é higroscópico, portanto, se ficar exposto ao meio ambiente, vai se juntando aos poucos com a umidade do ar, formando Ba (OH)dois que se combina com dióxido de carbono COdois do ar para dar carbonato de bário BaCO3.
Quando o monóxido de bário BaO é aquecido na presença de ar, ele se combina com o oxigênio para formar o peróxido de bário BaOdois. A reação é reversível.
2 BaO + Odois ⇔ 2 BaOdois
Na presença de água, pode reagir com alumínio Al ou zinco Zn, formando os óxidos ou hidróxidos dos referidos metais e gerando hidrogênio gasoso Hdois.
Pode iniciar a polimerização de compostos orgânicos polimerizáveis, como epóxidos.
Riscos
Pode ser tóxico se ingerido. Não deve entrar em contato com a pele. É irritante para os olhos, pele e vias respiratórias. Pode ser prejudicial ao sistema nervoso. É capaz de causar baixos níveis de potássio, resultando em distúrbios cardíacos e musculares.
Obtendo
O óxido de bário BaO pode ser obtido por aquecimento de carbonato de bário BaCO3 com carvão. BaO é formado e monóxido de carbono gasoso CO é liberado.
Baco3 + C → BaO + 2 CO ↑
Formulários
Como um dessecante para solventes orgânicos
Devido à sua facilidade de reação com a água, o BaO é utilizado desde meados do século passado como dessecante de gasolina e solventes orgânicos básicos ou neutros..
O BaO é muito ativo na secagem ao seu redor, retira a umidade muito rapidamente, com evolução de bastante calor, formando o hidróxido de bário Ba (OH)dois que é estável até cerca de 1000 ºC. Por esse motivo, o BaO pode ser usado em altas temperaturas..
Ele também tem uma alta capacidade de absorção de água. Para cada molécula de BaO, um da água e o Ba (OH) podem ser absorvidosdois resultante também pode absorver uma certa quantidade de água.
É adequado para laboratórios de química analítica. Não pegajoso.
Pode ser usado em dessecadores, que são grandes recipientes de vidro com tampa onde o ambiente interno é mantido seco. BaO mantém a atmosfera em miniatura do dessecador seca.

Esses dessecadores são usados para colocar substâncias ou reagentes e, assim, evitar que absorvam água do meio ambiente.
Também é usado para secar gases básicos, como NH-amônia.3.
Em lâmpadas de descarga
O BaO é colocado nos eletrodos das lâmpadas de descarga como um material emissor de elétrons.
As lâmpadas de descarga são feitas de um tubo de vidro, quartzo ou outro material adequado, contêm um gás inerte e na maioria dos casos um vapor de metal. O vapor metálico pode ser sódio ou mercúrio.

Descargas elétricas ocorrem dentro do tubo porque ele tem um eletrodo positivo e um negativo.
O BaO é colocado nos eletrodos da lâmpada. Os elétrons que ele emite colidem com os átomos do vapor do metal e transmitem energia a eles..
Quando uma corrente elétrica passa por esse gás ou vapor, é produzida luz visível ou radiação ultravioleta (UV)..
Na fabricação de cerâmicas
BaO é usado em composições de revestimento de esmalte cerâmico.

No entanto, também foi testado como aditivo na preparação de vitrocerâmica..
O BaO melhora efetivamente as características mecânicas e resistência química deste tipo de cerâmica. Tem forte influência nas propriedades térmicas e na composição da fase cristalina dos materiais obtidos..
Na preparação de misturas de cimento
BaO foi testado como um componente de cimento de fosfoaluminato.
Este tipo de cimento é útil em ambientes marinhos, uma vez que não tem a mesma tendência de hidratação dos outros tipos de cimento, por isso não sofre formação de poros ou dilatação..
No entanto, os cimentos de fosfoaluminato precisam ser fortalecidos em seu desempenho mecânico para resistir às correntes marinhas e aos golpes de pedaços flutuantes de gelo presentes no oceano..
A adição de BaO ao cimento de fosfoaluminato modifica a estrutura mineral do referido material, melhora a estrutura dos poros e aumenta consideravelmente a resistência à compressão da pasta de cimento..
Ou seja, o BaO melhora a resistência à compressão desse tipo de cimento..

Em várias aplicações
É utilizado como ingrediente para fornecer opacidade em resinas dentais para preenchimento de orifícios nos dentes, realizado por dentistas.
Ele também é usado como um agente de nucleação para a preparação de polímeros de fluoreto de polivinilideno que são usados para isolar cabos de alimentação..
Referências
- Partyka, J. et al. (2016). Efeito da adição de BaO na sinterização de materiais vitrocerâmicos de SiOdois-Para odoisOU3-N / DdoisCERTOdoisSistema O-CaO / MgO. J Therm Anal Calorim (2016) 125: 1095. Recuperado de link.springer.com.
- Zhang, P. et al. (2019). Efeito do BaO na estrutura mineral e comportamento de hidratação do cimento de fosfoaluminato. J Therm Anal Calorim (2019) 136: 2319. Recuperado de link.springer.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Óxido de bário. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Iluminação. Princípio. No livro de referência do engenheiro elétrico (décima sexta edição). Recuperado de sciencedirect.com.
- Ebnesajjad, S. (2003). Espumas de fluoropolímero. Espuma PVDF. Em Fluoroplásticos Processáveis por Fusão. Recuperado de sciencedirect.com.
- Booth, H.S. e McIntyre, L.H. (1930). Óxido de bário como dessecante. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Recuperado de pubs.acs.org.

Ainda sem comentários