
Volume atômico, como varia na tabela periódica e exemplos
O volume atômico é um valor relativo que indica a relação entre a massa molar de um elemento e sua densidade. Portanto, esse volume depende da densidade do elemento, e a densidade depende, por sua vez, da fase e de como os átomos estão dispostos dentro dela..
Assim, o volume atômico de um elemento Z não é o mesmo em uma fase diferente daquela que exibe à temperatura ambiente (líquida, sólida ou gasosa), ou quando faz parte de certos compostos. Assim, o volume atômico de Z no composto ZA é diferente daquele de Z no composto ZB.

Por quê? Para entendê-lo, é necessário comparar átomos com, por exemplo, mármores. Os mármores, assim como os azulados da imagem acima, têm uma borda material muito bem definida, que pode ser vista graças ao brilho da superfície. Em contraste, o limite dos átomos é difuso, embora possam ser considerados remotamente esféricos.
Assim, o que determina um ponto além da fronteira atômica é a probabilidade nula de encontrar um elétron, e esse ponto pode estar mais longe ou mais perto do núcleo, dependendo de quantos átomos vizinhos interagem em torno do átomo em consideração..
Índice do artigo
- 1 volume atômico e raio
- 2 Fórmula adicional
- 3 Como o volume atômico varia na tabela periódica?
- 3.1 Volumes atômicos de metais de transição
- 4 exemplos
- 4.1 Exemplo 1
- 4.2 Exemplo 2
- 5 referências
Volume atômico e raio
Ao interagir com dois átomos de H na molécula de Hdois, as posições de seus núcleos são definidas, bem como as distâncias entre eles (distâncias internucleares). Se ambos os átomos são esféricos, o raio é a distância entre o núcleo e o limite difuso:
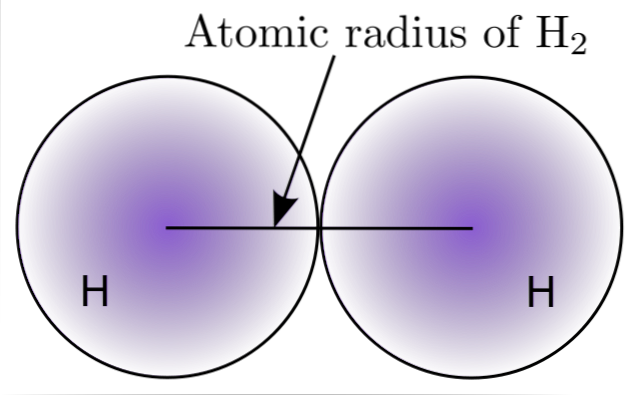
Na imagem acima você pode ver como a probabilidade de encontrar um elétron diminui à medida que ele se afasta do núcleo. Então, dividindo a distância internuclear por dois, o raio atômico é obtido. Em seguida, assumindo uma geometria esférica para os átomos, a fórmula é usada para calcular o volume de uma esfera:
V = (4/3) (Pi) r3
Nesta expressão r é o raio atômico determinado para a molécula Hdois. O valor de V calculado por este método impreciso pode mudar se, por exemplo, H for consideradodois no estado líquido ou metálico. No entanto, esse método é muito impreciso porque as formas dos átomos estão muito longe da esfera ideal em suas interações..
Para determinar os volumes atômicos em sólidos, muitas variáveis relativas ao arranjo são levadas em consideração, e que são obtidas por estudos de difração de raios-X..
Fórmula adicional
A massa molar expressa a quantidade de matéria que possui um mol de átomos de um elemento químico.
Suas unidades são g / mol. Por outro lado, densidade é o volume que um grama do elemento ocupa: g / mL. Como as unidades de volume atômico são mL / mol, você deve brincar com as variáveis para chegar às unidades desejadas:
(g / mol) (mL / g) = mL / mol
Ou o que é o mesmo:
(Massa molar) (1 / D) = V
(Massa molar / D) = V
Assim, o volume de um mol de átomos de um elemento pode ser facilmente calculado; enquanto que com a fórmula do volume esférico, o volume de um átomo individual é calculado. Para chegar a este valor desde o primeiro, é necessária uma conversão através do número de Avogadro (6,02 · 10-2,3).
Como o volume atômico varia na tabela periódica?
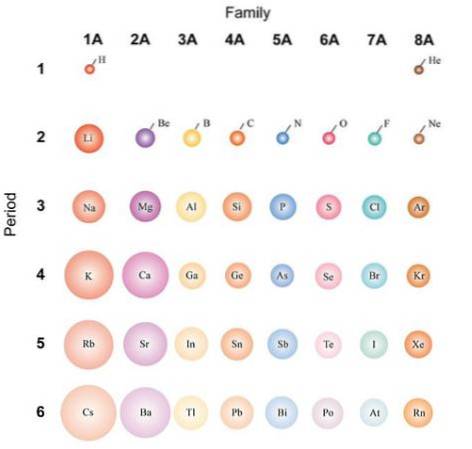
Se os átomos forem considerados esféricos, sua variação será a mesma observada nos raios atômicos. Na imagem acima, que mostra elementos representativos, é ilustrado que da direita para a esquerda os átomos ficam menores; em vez disso, de cima para baixo, eles se tornam mais volumosos.
Isso porque, no mesmo período, o núcleo incorpora prótons à medida que se move para a direita. Esses prótons exercem uma força atrativa sobre os elétrons externos, que sentem uma carga nuclear efetiva Zef, menos do que a carga nuclear real Z.
Os elétrons das camadas internas repelem os da camada externa, reduzindo o efeito do núcleo sobre eles; isso é conhecido como efeito de tela. No mesmo período, o efeito de tela não pode neutralizar o aumento no número de prótons, de modo que os elétrons na camada interna não evitam que os átomos se contraiam..
No entanto, a descida em um grupo permite novos níveis de energia, o que permite que os elétrons orbitem mais longe do núcleo. Da mesma forma, aumenta o número de elétrons na camada interna, cujos efeitos de proteção começam a diminuir se o núcleo adicionar prótons novamente..
Por estas razões, é apreciado que o grupo 1A tem os átomos mais volumosos, ao contrário dos átomos pequenos do grupo 8A (ou 18), os dos gases nobres..
Volumes atômicos de metais de transição
Os átomos do metal de transição incorporam elétrons nos orbitais d internos. Esse aumento no efeito de tela e, assim como na carga nuclear real Z, se anula quase igualmente, de modo que seus átomos mantêm tamanho semelhante no mesmo período..
Em outras palavras: em um período, os metais de transição exibem volumes atômicos semelhantes. No entanto, essas pequenas diferenças são extremamente significativas na definição de cristais metálicos (como se fossem mármores metálicos).
Exemplos
Duas fórmulas matemáticas estão disponíveis para calcular o volume atômico de um elemento, cada uma com seus exemplos correspondentes.
Exemplo 1
Dado o raio atômico do hidrogênio -37 pm (1 picômetro = 10-12m) - e césio -265 pm-, calcule seus volumes atômicos.
Usando a fórmula do volume esférico, temos então:
VH= (4/3) (3,14) (37 pm)3= 212,07 pm3
VCs= (4/3) (3,14) (265 pm)3= 77912297,67 pm3
Porém, esses volumes expressos em picômetros são exorbitantes, por isso são transformados em unidades de angstroms, multiplicando-os pelo fator de conversão (1Å / 100pm)3:
(212.07 pm3) (1Å / 100pm)3= 2,1207 × 10-4 PARA3
(77912297,67 pm3) (1Å / 100pm)3= 77,912 Å3
Assim, as diferenças de tamanho entre o pequeno átomo de H e o volumoso átomo de Cs são evidenciadas numericamente. Deve-se ter em mente que esses cálculos são apenas aproximações sob a afirmação de que um átomo é totalmente esférico, que vagueia na frente da realidade..
Exemplo 2

A densidade do ouro puro é 19,32 g / mL e sua massa molar é 196,97 g / mol. Aplicando a fórmula M / D para calcular o volume de um mol de átomos de ouro, obtém-se o seguinte:
VAu= (196,97 g / mol) / (19,32 g / mL) = 10,19 mL / mol
Ou seja, 1 mole de átomos de ouro ocupa 10,19 mL, mas que volume um átomo de ouro ocupa especificamente? E como expressá-lo em unidades de pm3? Para isso, basta aplicar os seguintes fatores de conversão:
(10,19 mL / mol) · (mol / 6,02 · 10-2,3 átomos) · (1 m / 100 cm)3(13h / 10-12m)3= 16,92 · 106 PM3
Por outro lado, o raio atômico do ouro é 166 pm. Comparando-se os dois volumes - o obtido pelo método anterior e o calculado pela fórmula do volume esférico - verificar-se-á que não têm o mesmo valor:
VAu= (4/3) (3,14) (166 pm)3= 19,15 · 106 PM3
Qual dos dois está mais próximo do valor aceito? O que mais se aproxima dos resultados experimentais obtidos por difração de raios X da estrutura cristalina do ouro.
Referências
- Helmenstine, Anne Marie, Ph.D. (09 de dezembro de 2017). Definição de Volume Atômico. Obtido em 6 de junho de 2018, em: Thoughtco.com
- Mayfair, Andrew. (13 de março de 2018). Como calcular o volume de um átomo. Ciência. Obtido em 6 de junho de 2018, em: sciencing.com
- Wiki Kids Ltd. (2018). Curvas de volume atômico de Lothar Meyer. Obtido em 6 de junho de 2018, em: wonderwhizkids.com
- Lúmen. Tendências periódicas: raio atômico. Obtido em 6 de junho de 2018, em :ourses.lumenlearning.com
- Camilo J. Derpich. Volume atômico e densidade. Obtido em 6 de junho de 2018, em: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 222-224.
- Fundação CK-12. (22 de fevereiro de 2010). Tamanhos atômicos comparativos. [Figura]. Obtido em 6 de junho de 2018, em: commons.wikimedia.org
- Fundação CK-12. Edição (22 de fevereiro de 2010). Raio atômico de Hdois. [Figura]. Obtido em 6 de junho de 2018, em: commons.wikimedia.org
Ainda sem comentários