
Estrutura Química de Tusfrano, Propriedades e Usos
O Tusfrano É um elemento químico radioativo que pertence ao grupo 13 (IIIA) e período 7 da tabela periódica. Não é alcançado na natureza, ou pelo menos não em condições terrestres. Sua meia-vida é de apenas cerca de 38 ms a um minuto; portanto, sua grande instabilidade o torna um elemento muito evasivo.
Na verdade, estava tão instável no início de sua descoberta que a IUPAC (União Internacional de Química Pura e Aplicada) não deu uma data definida para o evento na época. Por isso, sua existência como elemento químico não foi oficializada e ficou no escuro..
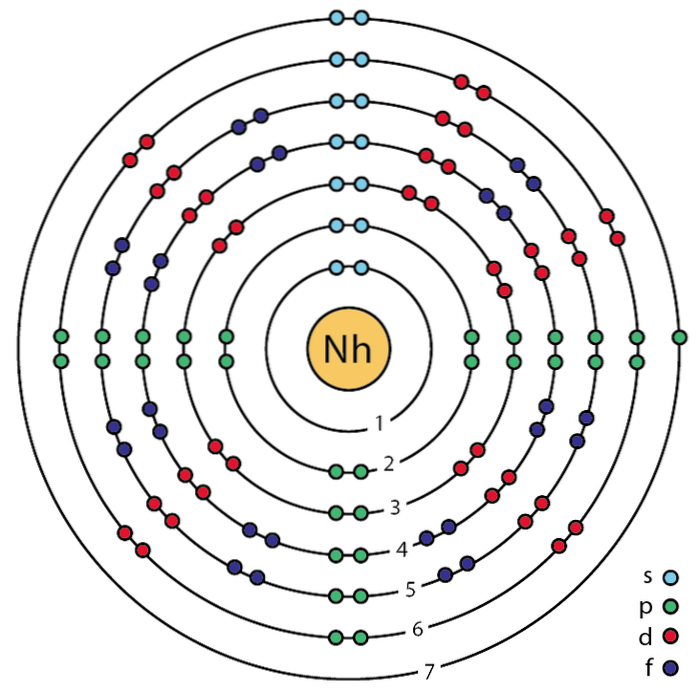
Seu símbolo químico é Tf, a massa atômica é 270 g / mol, tem um Z igual a 113 e uma configuração de valência [Rn] 5f146d107sdois7p1. Além disso, os números quânticos de seu elétron diferencial são (7, 1, -1, +1/2). A imagem acima mostra o modelo de Bohr para o átomo de tusfrano..
Este átomo era anteriormente conhecido como ununtrium e hoje foi oficializado com o nome de Nihonium (Nh). No modelo você pode verificar, como um jogo, os elétrons das camadas interna e de valência para o átomo de Nh.
Índice do artigo
- 1 Descoberta do tusfrano e oficialização do Niônio
- 1,1 Nihonium
- 2 Estrutura química
- 3 propriedades
- 3.1 Ponto de fusão
- 3.2 Ponto de ebulição
- 3,3 Densidade
- 3.4 Entalpia de vaporização
- 3,5 Raio covalente
- 3,6 estados de oxidação
- 4 usos
- 5 referências
Descoberta do tusfrano e oficialização do Niônio
Uma equipe de cientistas do Laboratório Nacional Lawrence Livermore, nos Estados Unidos, e um grupo de Dubna, na Rússia, descobriram o tusfrano. Essa descoberta aconteceu entre 2003 e 2004.
Por outro lado, pesquisadores do Laboratório Riken, do Japão, conseguiram sintetizá-lo, sendo o primeiro elemento sintético produzido naquele país..
Era derivado da decomposição radioativa do elemento 115 (unumpentium, Uup), da mesma forma que os actinídeos são produzidos a partir da decomposição do urânio..
Antes de sua aceitação oficial como um novo elemento, a IUPAC o nomeou provisoriamente como um ununtrium (Uut). Untrium (Untrium, em inglês) significa (um, um, três); isto é, 113, que é o seu número atômico escrito em unidades.
O nome ununtrio foi devido aos regulamentos da IUPAC de 1979. No entanto, de acordo com a nomenclatura de Mendeleev para elementos ainda não descobertos, seu nome deve ter sido Eka-thallium ou dvi-indiano..
Por que tálio e índio? Por serem os elementos do grupo 13 mais próximos a ele e, portanto, devem ter alguma semelhança físico-química com eles.
Nihonium
Oficialmente, aceita-se que se trata da decadência radioativa do elemento 115 (moscovio), tendo o nome Nihonium, com o símbolo químico de Nh.
"Nihon" é um termo utilizado para designar o Japão, apresentando assim seu nome na tabela periódica.
Nas tabelas periódicas anteriores a 2017, aparecem tusfrano (Tf) e unumpentium (Uup). No entanto, na grande maioria das tabelas periódicas de antes, o ununtrium substitui o tusfrano..
Atualmente, Nihonium ocupa o lugar de Tusfrano na tabela periódica, e Muscovium também substitui Unumpentium. Esses novos elementos completam o período 7 com tenesin (Ts) e oganesón (Og).
Estrutura química
À medida que se desce pelo grupo 13 da tabela periódica, a família da terra (boro, alumínio, gálio, índio, tálio e tusfrano), o caráter metálico dos elementos aumenta..
Assim, tusfrano é o elemento do grupo 13 com maior caráter metálico. Seus volumosos átomos devem adotar algumas das possíveis estruturas cristalinas, entre as quais estão: bcc, ccp, hcp e outras..
Qual destes? Essa informação ainda não está disponível. No entanto, uma conjectura seria assumir uma estrutura não muito compacta e uma célula unitária com um volume maior que o cúbico..
Propriedades
Por ser um elemento elusivo e radioativo, muitas de suas propriedades são previstas e, portanto, não oficiais..
Ponto de fusão
700K.
Ponto de ebulição
1400K.
Densidade
16 Kg / m3
Entalpia de vaporização
130 kJ / mol.
Raio covalente
136 pm.
Estados de oxidação
+1, +3 e +5 (como o resto dos elementos do grupo 13).
A partir do restante de suas propriedades, pode-se esperar que apresentem comportamentos semelhantes aos dos metais pesados ou de transição..
Formulários
Pelas suas características, as aplicações industriais ou comerciais são nulas, por isso é utilizado apenas para pesquisas científicas.
No futuro, a ciência e a tecnologia podem colher alguns benefícios recém-revelados. Talvez, para elementos extremos e instáveis como o niônio, seus possíveis usos também caiam em cenários extremos e instáveis para os tempos atuais..
Além disso, seus efeitos na saúde e no meio ambiente ainda não foram estudados devido à sua vida útil limitada. Por este motivo, não se conhece qualquer aplicação possível em medicina ou o grau de toxicidade..
Referências
- Ahazard.sciencewriter. Modelo Bohr aprimorado com 113 niônio (Nh). (2016, 14 de junho). [Figura]. Obtido em 30 de abril de 2018, em: commons.wikimedia.org
- Royal Society of Chemistry. (2017). Nihonium. Recuperado em 30 de abril de 2018, em: rsc.org
- Tim Sharp. (1 de dezembro de 2016). Fatos sobre Nihonium (Elemento 113). Obtido em 30 de abril de 2018, em: livescience.com
- Lulia Georgescu. (24 de outubro de 2017). Nihonium, o obscuro. Obtido em 30 de abril de 2018, em: nature.com
- Os editores da Encyclopaedia Britannica. (2018). Nihonium. Obtido em 30 de abril de 2018, em: britannica.com



Ainda sem comentários