
Estrutura, propriedades, usos do tetracloreto de carbono (CCl4)
O tetracloreto de carbono é um líquido incolor, com odor levemente adocicado, semelhante ao odor do éter e do clorofórmio. Sua fórmula química é CCl4, e constitui um composto covalente e volátil, cujo vapor é de maior densidade que o ar; não é um condutor de eletricidade nem é inflamável.
Pode ser encontrada na atmosfera, nas águas dos rios, no mar e nos sedimentos da superfície marinha. Acredita-se que o tetracloreto de carbono presente nas algas vermelhas seja sintetizado pelo mesmo organismo.
Na atmosfera, é produzido pela reação de cloro e metano. O tetracloreto de carbono produzido industrialmente entra no oceano, principalmente através da interface mar-ar. Seu fluxo atmosférico => oceânico foi estimado em 1,4 x 1010 g / ano, equivalente a 30% do tetracloreto de carbono total na atmosfera.
Índice do artigo
- 1 características principais
- 2 Estrutura
- 3 Propriedades físicas e químicas
- 4 usos
- 4.1 Fabricação de produtos químicos
- 4.2 Fabricação de refrigerantes
- 4.3 Supressão de incêndio
- 4.4 Limpeza
- 4.5 Análise Química
- 4.6 Espectroscopia de infravermelho e ressonância magnética nuclear
- 4.7 Solvente
- 4.8 Outros usos
- 5 Toxicidade
- 5.1 Mecanismos hepatotóxicos
- 5.2 Efeitos tóxicos nos sistemas nervoso central e renal
- 5.3 Efeitos da exposição em humanos
- 5.4 Interações tóxicas
- 6 interações intermoleculares
- 7 referências
Características principais
O tetracloreto de carbono é produzido industrialmente por cloração térmica do metano, reagindo o metano com o gás cloro a uma temperatura entre 400ºC a 430ºC. Durante a reação, um produto bruto é gerado, com um subproduto de ácido clorídrico.
Também é produzido industrialmente pelo método de dissulfeto de carbono. O cloro e o dissulfeto de carbono reagem a uma temperatura de 90 ° C a 100 ° C, usando ferro como catalisador. Em seguida, o produto bruto é submetido a fracionamento, neutralização e destilação.
O CCl4 Teve múltiplas utilizações, entre outras: solvente para gorduras, óleos, vernizes, etc.; lavagem a seco de roupas; pesticidas, fumigação agrícola e fungicida e fabricação de Nylon. Porém, apesar de sua grande utilidade, seu uso tem sido parcialmente descartado devido à alta toxicidade que apresenta..
Em humanos, gera efeitos tóxicos na pele, olhos e trato respiratório. Mas seus efeitos mais prejudiciais ocorrem no funcionamento do sistema nervoso central, fígado e rins. Danos renais são talvez a principal causa de mortes atribuídas à ação tóxica do tetracloreto de carbono.
Estrutura
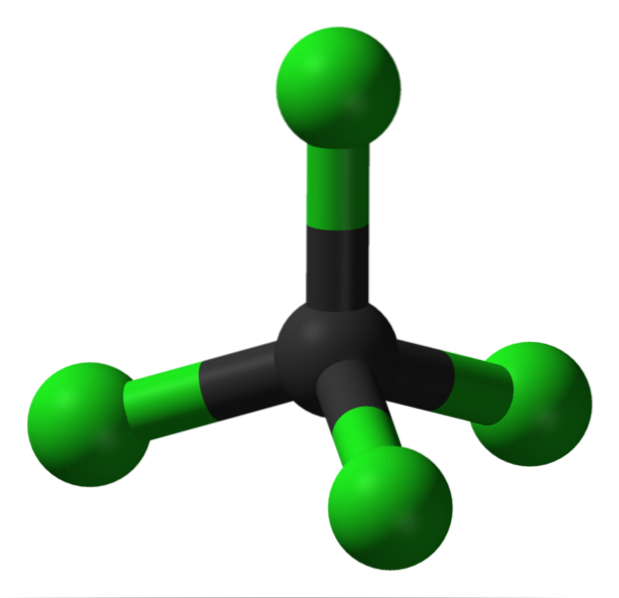
Na imagem você pode ver a estrutura do tetracloreto de carbono, que é de geometria tetraédrica. Observe que os átomos de Cl (as esferas verdes) são orientados no espaço ao redor do carbono (esfera preta) desenhando um tetraedro.
Da mesma forma, deve ser mencionado que como todos os vértices do tetraedro são idênticos, a estrutura é simétrica; ou seja, não importa como a molécula CCl é girada4, sempre será o mesmo. Então, uma vez que o tetraedro verde de CCl4 é simétrico, resulta na ausência de um momento de dipolo permanente.
Por quê? Porque embora as ligações C-Cl sejam polares em caráter devido à maior eletronegatividade de Cl em relação a C, esses momentos se cancelam vetorialmente. Portanto, é um composto orgânico clorado apolar..
O carbono é totalmente clorado em CCl4, que é igual a alta oxidação (o carbono pode formar no máximo quatro ligações com o cloro). Este solvente não tende a perder elétrons, é aprótico (não contém hidrogênios) e representa um pequeno meio de transporte e armazenamento de cloro..
Propriedades físicas e químicas
Fórmula
CCl4
Peso molecular
153,81 g / mol.
Aspecto físico
É um líquido incolor. Cristaliza na forma de cristais monoclínicos.
Odor
Possui o odor característico presente em outros solventes clorados. O cheiro é aromático e um tanto doce, semelhante ao cheiro de tetracloroetileno e clorofórmio.
Ponto de ebulição
170,1ºF (76,8ºC) a 760 mmHg.
Ponto de fusão
-9ºF (-23ºC).
Solubilidade em água
É pouco solúvel em água: 1,16 mg / mL a 25 ºC e 0,8 mg / mL a 20 ºC. Por quê? Porque a água, uma molécula altamente polar, não "sente" afinidade pelo tetracloreto de carbono, que é apolar..
Solubilidade em solventes orgânicos
Devido à simetria de sua estrutura molecular, o tetracloreto de carbono é um composto apolar. Portanto, é miscível com álcool, benzeno, clorofórmio, éter, dissulfeto de carbono, éter de petróleo e nafta. Da mesma forma, é solúvel em etanol e acetona..
Densidade
No estado líquido: 1,59 g / ml a 68 º F e 1,594 g / ml a 20 ºC.
No estado sólido: 1,831 g / ml a -186 ºC e 1,809 g / ml a -80 ºC.
Estabilidade
Geralmente inerte.
Ação corrosiva
Ataca algumas formas de plásticos, borrachas e revestimentos.
ponto de ignição
É considerado pouco inflamável, indicando o ponto de ignição inferior a 982 ºC.
Auto ignição
982 ºC (1800 º F; 1255 K).
Densidade do vapor
5,32 em relação ao ar, tomado como valor de referência igual a 1.
Pressão de vapor
91 mmHg a 68 ° F; 113 mmHg a 77ºF e 115 mmHg a 25ºC.
Decomposição
Na presença de fogo, forma cloreto e fosgênio, um composto altamente tóxico. Da mesma forma, nas mesmas condições, ele se decompõe em cloreto de hidrogênio e monóxido de carbono. Na presença de água em altas temperaturas, pode causar ácido clorídrico.
Viscosidade
2,03 x 10-3 Pa s
Limiar de odor
21,4 ppm.
Índice de refração (ηD)
1,4607.
Formulários
Manufatura química
-Atua como agente de cloração e / ou solvente na fabricação de cloro orgânico. Da mesma forma, intervém como monômero na fabricação do Nylon..
-Atua como solvente na fabricação de cimento de borracha, sabão e inseticida.
-É usado na fabricação do propelente clorofluorocarbono.
-Por não possuir ligações C-H, o tetracloreto de carbono não sofre reações de radicais livres, tornando-se um solvente útil para halogenações, seja por um halogênio elementar, seja por um reagente halogenante, como a N-bromossuccinimida..
Fabricação de refrigerante
Foi utilizado na produção de clorofluorocarbono, refrigerante R-11 e triclorofluorometano, refrigerante R-12. Esses refrigerantes destroem a camada de ozônio, razão pela qual se recomendou a suspensão de seu uso, de acordo com as recomendações do Protocolo de Montreal..
Contenção do fogo
No início do século 20, o tetracloreto de carbono passou a ser utilizado como extintor de incêndio, com base em um conjunto de propriedades do composto: é volátil; seu vapor é mais pesado que o ar; não é um condutor elétrico e não é muito inflamável.
Quando o tetracloreto de carbono é aquecido, ele se transforma em um vapor pesado que cobre os produtos da combustão, isolando-os do oxigênio presente no ar e fazendo com que o fogo se extinga. É adequado para combater incêndios em aparelhos e óleo.
Porém, em temperaturas superiores a 500 ºC, o tetracloreto de carbono pode reagir com a água, causando fosgênio, um composto tóxico, portanto, deve-se prestar atenção à ventilação durante o uso. Além disso, pode reagir explosivamente com o sódio metálico, devendo ser evitado seu uso em incêndios com a presença desse metal..
Limpeza
O tetracloreto de carbono é usado há muito tempo na lavagem a seco de roupas e outros materiais domésticos. Além disso, é utilizado como desengraxante industrial de metais, excelente para dissolver graxas e óleos.
Análises químicas
Usado para a detecção de boro, brometo, cloreto, molibdênio, tungstênio, vanádio, fósforo e prata.
Espectroscopia infravermelha e ressonância magnética nuclear
-É utilizado como solvente em espectroscopia de infravermelho, visto que o tetracloreto de carbono não possui absorção significativa em bandas> 1600 cm-1.
-Foi utilizado como solvente na ressonância magnética nuclear, pois não interferiu na técnica por não possuir hidrogênio (é aprótico). Porém, devido à sua toxicidade e baixo poder solvente, o tetracloreto de carbono foi substituído por solventes deuterados..
Solvente
A característica de ser um composto apolar permite o uso de tetracloreto de carbono como agente de dissolução de óleos, gorduras, lacas, vernizes, ceras de borracha e resinas. Também pode dissolver o iodo.
Outros usos
-É um componente importante em lâmpadas de lava, pois o tetracloreto de carbono adiciona peso à cera devido à sua densidade..
-Usado por colecionadores de selos, pois revela marcas d'água em selos sem causar danos.
-Tem sido utilizado como agente pesticida e fungicida e na fumigação de grãos para a eliminação de insetos..
-No processo de corte de metal é usado como lubrificante.
-Tem sido utilizado na medicina veterinária como anti-helmíntico no tratamento da fasciolase, causada por Fasciola hepatica em ovinos..
Toxicidade
-O tetracloreto de carbono pode ser absorvido pelas vias respiratória, digestiva, ocular e cutânea. A ingestão e inalação são muito perigosas, pois podem causar danos graves a longo prazo ao cérebro, fígado e rins..
-O contato com a pele causa irritação e, a longo prazo, pode causar dermatite. Embora o contato com os olhos cause irritação.
Mecanismos hepatotóxicos
Os principais mecanismos que produzem danos ao fígado são o estresse oxidativo e a alteração da homeostase do cálcio.
O estresse oxidativo é um desequilíbrio entre a produção de espécies reativas de oxigênio e a capacidade do corpo de gerar um ambiente redutor, dentro de suas células, que controla os processos oxidativos..
O desequilíbrio no estado redox normal pode causar efeitos tóxicos devido à produção de peróxidos e radicais livres que danificam todos os componentes das células..
O tetracloreto de carbono é metabolizado produzindo radicais livres: Cl3C. (radical triclorometil) e Cl3COO. (radical peróxido de triclorometila). Esses radicais livres produzem lipoperoxidação, que causa danos ao fígado e também aos pulmões.
Os radicais livres também causam a quebra da membrana plasmática das células do fígado. Isso produz um aumento na concentração de cálcio citosólico e uma diminuição no mecanismo intracelular de sequestro de cálcio..
O cálcio intracelular aumentado ativa a enzima fosfolipase Adois que atua sobre os fosfolipídios da membrana, agravando sua afetação. Além disso, há infiltração de neutrófilos e lesão hepatocelular. Há uma diminuição na concentração celular de ATP e glutationa que causa inativação enzimática e morte celular.
Efeitos tóxicos no sistema renal e no sistema nervoso central
Os efeitos tóxicos do tetracloreto de carbono se manifestam no sistema renal com a diminuição da produção de urina e o acúmulo de água no corpo. Principalmente nos pulmões e aumento da concentração de resíduos metabólicos no sangue. Isso pode causar a morte.
Ao nível do sistema nervoso central, há envolvimento da condução axonal dos impulsos nervosos.
Efeitos da exposição em humanos
Curta duração
Irritação ocular; efeitos no fígado, rins e sistema nervoso central, que podem levar à perda de consciência.
Longa duração
Dermatite e possível ação cancerígena.
Interações tóxicas
Há uma associação entre muitos dos casos de envenenamento por tetracloreto de carbono e o uso de álcool. O consumo excessivo de álcool causa danos ao fígado, em alguns casos causando cirrose hepática.
Observou-se que a toxicidade do tetracloreto de carbono aumenta com os barbitúricos, pois eles têm alguns efeitos tóxicos semelhantes..
Por exemplo, a nível renal, os barbitúricos reduzem a excreção urinária, sendo esta ação dos barbitúricos semelhante ao efeito tóxico do tetracloreto de carbono na função renal..
Interações intermoleculares
O CCl4 pode ser considerado um tetraedro verde. Como você interage com outras pessoas?
Por ser uma molécula apolar, sem momento de dipolo permanente, ela não pode interagir por meio de forças dipolo-dipolo. Para manter suas moléculas juntas no líquido, os átomos de cloro (os vértices dos tetraedros) devem interagir uns com os outros de alguma forma; e eles fazem isso graças às forças de dispersão de Londres.
As nuvens eletrônicas de átomos de Cl se movem e, por breves momentos, geram áreas ricas e pobres em elétrons; ou seja, eles geram dipolos instantâneos.
A zona rica em elétrons δ faz com que o átomo de Cl de uma molécula vizinha se polarize: Clδ- δ+Cl. Assim, dois átomos de Cl podem ser mantidos juntos por um tempo limitado..
Mas, uma vez que existem milhões de moléculas CCl4, as interações tornam-se eficazes o suficiente para formar um líquido em condições normais.
Além disso, os quatro Cl covalentemente ligados a cada C aumentam consideravelmente o número dessas interações; tanto que ferve a 76,8ºC, um ponto de ebulição alto.
O ponto de ebulição do CCl4 não pode ser maior porque os tetraedros são relativamente pequenos em comparação com outros compostos apolares (como o xileno, que ferve a 144ºC).
Referências
- Hardinger A. Steven. (2017). Glossário Ilustrado de Química Orgânica: Tetracloreto de carbono. Recuperado de: chem.ucla.edu
- Tudo Siyavula. (s.f.). Forças intermoleculares e interatômicas. Recuperado de: siyavula.com
- Carey F. A. (2006). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Wikipedia. (2018). Tetracloreto de carbono. Recuperado de: en.wikipedia.org
- PubChem. (2018). Tetracloreto de carbono. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Livro Químico. (2017). Tetracloreto de carbono. Recuperado de: chemicalbook.com



Ainda sem comentários