
Sulfato de cálcio (CaSO4) Estrutura química, propriedades, usos

O Sulfato de Calcio É um sal ternário de cálcio, metal alcalino-terroso (Sr. Becambara), enxofre e oxigênio. Sua fórmula química é CaSO4, o que significa que para cada cátion Cadois+ há um ânion SO4dois- interagindo com ele. Constitui um composto com ampla distribuição na natureza.
Suas formas mais abundantes são CaSO42hdoisO (gesso) e a forma anidra CaSO4 (a anidrita). Existe também uma terceira forma: o gesso de Paris, produzido por aquecimento do gesso (o hemidrato, CaSO41 / 2HdoisOU). Uma porção sólida deste sal ternário é mostrada na imagem inferior, com sua aparência esbranquiçada..

Índice do artigo
- 1 Estrutura química
- 2 propriedades
- 2.1 Fórmula molecular
- 2.2 Peso molecular anidro
- 2.3 Odor
- 2.4 Aparência
- 2,5 Densidade
- 2.6 Ponto de fusão
- 2.7 Solubilidade
- 2.8 Estabilidade
- 3 usos
- 3.1 Em construção e arte
- 3.2 Terapêutica
- 3.3 No processamento de alimentos
- 3.4 Como fertilizante e condicionador para solos de cultivo
- 3.5 Na produção de outros compostos
- 4 referências
Estrutura química
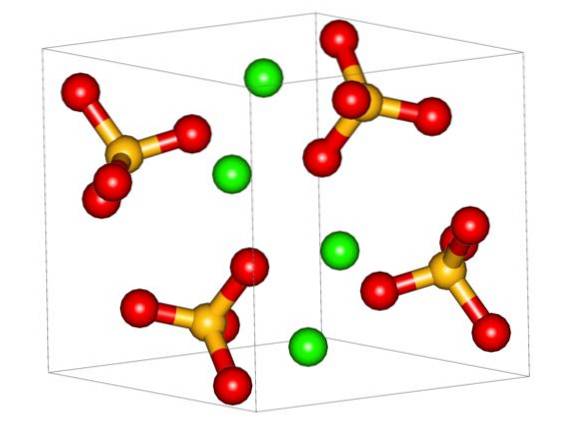
A imagem superior mostra a célula unitária ortorrômbica para CaSO4. Aqui, assume-se que as interações são puramente eletrostáticas; ou seja, os cátions Cadois+ atrair ânions tetraédricos SO4dois-.
No entanto, o Cadois+ é altamente propenso a se coordenar, formando estruturas poliédricas ao seu redor. A que se deve? Para a disponibilidade eletrônica de cálcio para aceitar elétrons de espécies básicas ou negativas (como os átomos de O de SO4dois-).
Considerando o ponto anterior, agora os íons de Cadois+ Eles aceitam links dativos (fornecidos pelo Os) e a célula unitária é transformada, conforme indicado na imagem abaixo:
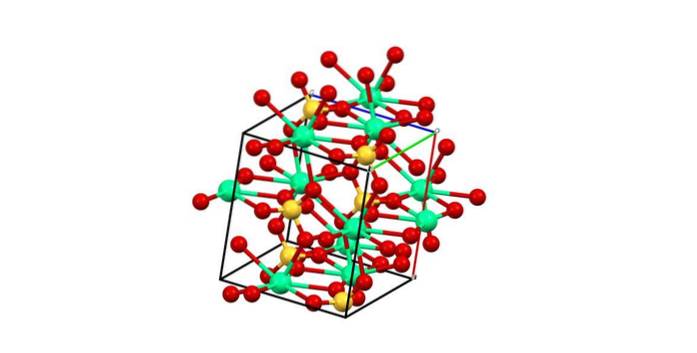
Consequentemente, o poliedro CaO é formado8 (a esfera verde de Cadois+ rodeado por oito esferas vermelhas de O do tetraedro SO4 próximo). Poliedros de cálcio e tetraedros de sulfato; esta é a estrutura cristalina do CaSO4 anidro.
Além disso, quando os cristais se hidratam - formando o sal di-hidratado ou o hemidrato (CaSO41/2 HdoisO) - a estrutura se expande para incorporar moléculas de água.
Essas moléculas podem se intercalar e coordenar com o cálcio; ou seja, eles substituem um ou dois grupos de sulfato.
Por outro lado, nem toda a água passa a fazer parte do poliedro CaO.8. Alguns, por outro lado, formam ligações de hidrogênio com sulfatos. Estes servem de união para duas seções em zigue-zague, produtos da disposição dos íons no cristal.
Propriedades
Fórmula molecular
CaSO4 nH2O.
Peso molecular anidro
136,134 g / mol.
Odor
É inodoro.
Aparência
No caso da anidrita, parece um pó branco ou cristais sólidos ortorrômbicos ou monoclínicos. Os cristais são de cor variável: podem ser brancos ou com tonalidade azulada, acinzentada ou avermelhada; também pode ser vermelho tijolo.
Densidade
2,96 g / cm3 (forma anidra). 2,32 gr / cm3 (forma di-hidratada).
Ponto de fusão
1450 ° C (2840 ° F). Característica de fortes interações eletrostáticas entre íons de Ca divalentesdois+ Eu sou4dois-.
Solubilidade
0,2-0,3% em água a 25 ° C É pouco solúvel em água e insolúvel em etanol.
Estabilidade
Estável à temperatura ambiente.
Formulários

Na construção e na arte
É utilizado na elaboração de estuques para frisar paredes de residências e outras construções que contribuam para seu embelezamento. Além disso, os relevos são feitos por meio de moldes nos tetos e nas esquadrias. O gesso também está no teto.
O sulfato de cálcio é utilizado para ajudar a resolver o problema que ocorre na hidratação do concreto, colaborando assim na construção de estradas, avenidas, etc..
Com o gesso são feitas esculturas, principalmente figuras religiosas, e nos cemitérios são utilizadas em lápides..
Terapêutica
veterinario
Experimentalmente, na medicina veterinária, pedaços estéreis de sulfato de cálcio têm sido usados para reparar defeitos ósseos ou cavidades, como as deixadas por feridas ou tumores..
O gesso pode ser usado para reparar defeitos ósseos devido à sua capacidade única de estimular a osteogênese. Estudos de raios-X e medronato de tecnécio (Tc99m) apóiam o uso do gesso como aloplástico e sua capacidade osteogênica quando implantado no seio frontal.
A regeneração óssea foi demonstrada em seis cães em um período de 4 a 6 meses. O sulfato de cálcio começou a ser utilizado nesta área em 1957, na forma de pastilhas de gesso de Paris, podendo preencher defeitos em ossos de cães..
A substituição óssea do sulfato de cálcio é comparável à observada no osso autogênico.
Ruhaimi (2001) aplicou sulfato de cálcio em um osso de mandíbula de coelho recentemente destruído, observando um aumento na osteogênese e calcificação óssea..
Medicamento
O sulfato de cálcio é utilizado na medicina para imobilizar articulações deslocadas e ossos fraturados, além de ser utilizado como excipiente na fabricação de comprimidos..
odontologia
Na odontologia é utilizado como base para a confecção de próteses dentárias, em restaurações e moldagens de dentes..
No processamento de alimentos
É usado como coagulante na produção de tofu, alimento feito com soja e muito consumido nos países orientais como substituto da carne. Além disso, tem sido utilizado como endurecedor de alimentos e no tratamento de farinhas..
Como fertilizante e condicionador para solos de cultivo
Gesso (CaSO42hdoisO) era utilizado como fertilizante na Europa desde o século XVIII, tendo a vantagem sobre o uso da cal como fonte de cálcio para maior mobilidade.
O cálcio deve estar disponível para as raízes das plantas para seu abastecimento adequado. Portanto, a adição de cálcio melhora as culturas hortícolas e de amendoim (amendoim)..
A podridão da raiz do amendoim causada por patógenos biológicos, assim como a podridão da extremidade da flor da melancia e do tomate, são parcialmente controladas com aplicações de gesso agrícola..
O gesso ajuda a reduzir a dispersão da argila, que provoca a formação de crostas no solo. Ao reduzir as crostas formadas no solo, o gesso facilita a saída das mudas. Também aumenta a entrada de ar e água no solo.
O gesso ajuda a melhorar o solo ao mitigar a acidez e a toxicidade do alumínio, adaptando assim a cultura para solos de sódio.
Na produção de outros compostos
O sulfato de cálcio reage com o bicarbonato de amônio para formar sulfato de amônio. Também tem sido usado no processo de produção de ácido sulfúrico.
O sulfato de cálcio anidro é misturado ao xisto ou pobre e, à medida que a mistura é aquecida, o trióxido de enxofre é liberado na forma gasosa. O óxido de enxofre é um precursor do ácido sulfúrico.
Referências
- Smokefoot. (26 de dezembro de 2015). Estrutura do CaSO4. [Figura]. Obtido em 6 de maio de 2018, em: commons.wikimedia.org
- Takanori Fukami et al. (2015). Síntese, estrutura cristalina e propriedades térmicas de CaSO42hdoisOu Cristais Simples. Jornal Internacional de Química; Vol. 7, No. 2; ISSN 1916-9698 E-ISSN 1916-9701 Publicado pelo Centro Canadense de Ciência e Educação.
- PubChem. (2018). Sulfato de Calcio. Obtido em 6 de maio de 2018, em: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Sulfato de Calcio. Obtido em 06 de maio de 2018, em: en.wikipedia.org
- Elsevier. (2018). Sulfato de Calcio. Obtido em 6 de maio de 2018, em: sciencedirect.com
- Kimberlitesoftwares. (2018). Sulfato de Cálcio. Obtido em 6 de maio de 2018, em: worldofchemicals.com
- Intagri. (2017). Manual para o uso de gesso agrícola como melhorador de solo. Obtido em 6 de maio de 2018, em: intagri.com



Ainda sem comentários