
História do selênio, propriedades, estrutura, obtenção, usos
O selênio É um elemento químico não metálico que pertence ao grupo 16 da tabela periódica e é representado pelo símbolo Se. Este elemento possui propriedades intermediárias entre o enxofre e o telúrio, que são membros do mesmo grupo.
O selênio foi descoberto em 1817 por Jöhs J. Berzelius e John G. Gahn, que ao vaporizar a pirita observou um resíduo vermelho (imagem inferior). No início, eles o confundiram com telúrio, mas depois perceberam que estavam lidando com um novo elemento.

Berzelius chamou o novo elemento de selênio, com base no nome "selene", que significa "deusa da lua". O selênio é um oligoelemento essencial para plantas e animais, embora em altas concentrações seja um elemento tóxico.
O selênio tem três formas alotrópicas principais: vermelho, preto e cinza. Este último tem a propriedade de modificar sua condutância elétrica em função da intensidade da luz que o irradia (fotocondutor), para a qual teve inúmeras aplicações..
O selênio é amplamente distribuído na crosta terrestre, porém os minerais que o contêm não são abundantes, portanto, não há mineração de selênio..
É obtido principalmente como um subproduto do processo de refino por eletrólise de cobre. O selênio se acumula no lodo encontrado no ânodo das células de eletrólise.
O ser humano possui cerca de 25 selenoproteínas, algumas das quais têm ação antioxidante e controlam a geração de radicais livres. Além disso, existem aminoácidos de selênio, como selenometionina e selenocisteína.
Índice do artigo
- 1 história
- 1.1 Primeira observação
- 1.2 Descoberta
- 1.3 Origem de seu nome
- 1.4 Desenvolvendo seus aplicativos
- 2 Propriedades físicas e químicas
- 2.1 Aparência
- 2.2 Peso atômico padrão
- 2.3 Número atômico (Z)
- 2.4 Ponto de fusão
- 2,5 ponto de ebulição
- 2.6 Densidade
- 2.7 Calor de fusão
- 2.8 Calor de vaporização
- 2,9 capacidade de calor molar
- 2,10 números de oxidação
- 2.11 Eletronegatividade
- 2.12 Energia de ionização
- 2.13 Ordem Magnética
- 2.14 Dureza
- 2,15 Isótopos
- 2,16 Alotropia
- 3 Reatividade
- 3.1 Reação com hidrogênio
- 3.2 Reação com oxigênio
- 3.3 Reação com halogênios
- 3.4 Reação com metais
- 3,5 Selenites
- 3,6 ácidos
- 4 Estrutura e configuração eletrônica
- 4.1 - Selênio e seus títulos
- 4.2 - Anéis ou correntes
- 4.3 - Alótropos
- 5 Onde encontrar e produção
- 5.1 Eletrólise de cobre
- 6 papel biológico
- 6.1 Deficiência
- 6.2 Co-fator de enzima
- 6.3 Proteínas e aminoácidos
- 7 riscos
- 8 usos
- 8.1 Cosméticos
- 8.2 Médicos
- 8.3 Eletrólise de manganês
- 8.4 Pigmento
- 8,5 Fotocondutor
- 8,6 Cristais
- 8.7 Vulcanização
- 8,8 Ligas
- 8.9 Retificadores
- 9 referências
História
Primeira observação
O alquimista Arnold de Villanova pode ter observado selênio em 1230. Ele se formou em medicina na Sorbonne em Paris e foi até o médico do Papa Clemente V.
Villanova em seu livro Rosarium Philosophorum descreve um enxofre vermelho ou "rebeum de enxofre" que foi deixado em uma fornalha após vaporizar o enxofre. Este enxofre vermelho pode ter sido um alótropo de selênio.
Descoberta
Em 1817, Jöhs Jakob Berzelius e John Gottlieb Gahn descobriram o selênio em uma fábrica química para a produção de ácido sulfúrico, perto de Gripsholm, na Suécia. A matéria-prima para fazer o ácido era a pirita, extraída de uma mina Falun..
Berzelius ficou surpreso com a existência de um resíduo vermelho que permaneceu no recipiente de chumbo após a queima do enxofre.
Além disso, Berzelius e Gahn observaram que o resíduo vermelho tinha um forte odor de raiz-forte, semelhante ao do telúrio. Por isso, ele escreveu ao amigo Marect que eles acreditavam que o depósito observado era um composto de telúrio..
No entanto, Berselius continuou a analisar o material depositado quando a pirita foi incinerada e reconsiderou que nenhum telúrio havia sido encontrado na mina Falun. Ele concluiu em fevereiro de 1818 que havia descoberto um novo elemento.
Origem do seu nome
Berzelius observou que o novo elemento era uma combinação de enxofre e telúrio, e que a semelhança do telúrio com o novo elemento lhe dera a oportunidade de nomear a nova substância de selênio..
Berzelius explicou que "tellus" significa deusa da terra. Martin Klaport em 1799 deu este nome ao telúrio e escreveu: “Nenhum elemento é chamado assim. Tinha que ser feito! ".
Devido à semelhança do telúrio com a nova substância, Berzelius o nomeou com a palavra selênio, derivada da palavra grega "selene", que significa "deusa da lua"..
Desenvolvimento de seus aplicativos
Em 1873, Willoughby Smith descobriu que a condutividade elétrica do selênio dependia da luz que o irradiava. Esta propriedade permitiu que o selênio tivesse inúmeras aplicações.
Alexander Graham Bell em 1979 usou selênio em seu fotofone. O selênio produz uma corrente elétrica proporcional à intensidade da luz que o ilumina, sendo utilizado em medidores de luz, mecanismos de segurança para abertura e fechamento de portas, etc..
O uso de retificadores de selênio na eletrônica começou na década de 1930, com inúmeras aplicações comerciais. Na década de 1970, foi suplantado nos retificadores pelo silício.
Em 1957, descobriu-se que o selênio era um elemento essencial para a vida dos mamíferos, uma vez que estava presente em enzimas que protegem do oxigênio reativo e dos radicais livres. Além disso, foi descoberta a existência de aminoácidos como a selenometionina.
Propriedades físicas e químicas
Aparência
Como existem vários alótropos para o selênio, sua aparência física varia. Geralmente ocorre como um sólido avermelhado na forma de pó.
Peso atômico padrão
78.971 u
Número atômico (Z)
3. 4
Ponto de fusão
221 ºC
Ponto de ebulição
685 ºC
Densidade
A densidade do selênio varia dependendo de qual alótropo ou polimorfo é considerado. Algumas de suas densidades determinadas à temperatura ambiente são:
Cinza: 4,819 g / cm3
Alfa: 4,39 g / cm3
Vítreo: 4,28 g / cm3
Estado líquido (ponto de fusão): 3,99 g / cm3
Calor de fusão
Cinza: 6,69 kJ / mol
Calor da vaporização
95,48 kJ / mol
Capacidade de calor molar
25,363 J / (mol K)
Números de oxidação
O selênio pode se ligar em seus compostos manifestando os seguintes números ou estados de oxidação: -2, -1, +1, +2, +3, +4, +5, +6. Entre todos eles, os mais importantes são -2 (Sedois-), +4 (Se4+) e +6 (Se6+).
Por exemplo, no SeOdois o selênio tem um número de oxidação de +4; ou seja, a existência do cátion Se é assumida4+ (Eu sei4+OUdoisdois-) Da mesma forma com SeO3 selênio tem um número de oxidação de +6 (Se6+OU3dois-).
Em seleneto de hidrogênio, HdoisSe, o selênio tem um número de oxidação de -2; isto é, novamente, a existência do íon ou ânion Se é assumidadois- (Hdois+eu seidois-) Isso ocorre porque o selênio é mais eletronegativo do que o hidrogênio..
Eletro-negatividade
2,55 na escala de Pauling.
Energia de ionização
-Primeiro: 941 kJ / mol.
-Segundo: 2.045 kJ / mol.
-Terceiro: 2.973,7 kJ / mol.
Ordem Magnética
Diamagnético.
Dureza
2,0 na escala de Mohs.
Isótopos
Existem cinco isótopos naturais e estáveis de selênio, que são mostrados abaixo com suas respectivas abundâncias:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Alotropia

O selênio preparado em reações químicas é um pó amorfo vermelho-tijolo que, quando derretido rapidamente, dá origem à forma negra vítrea, semelhante às contas do rosário (imagem superior). Black Selenium é um sólido quebradiço e brilhante.
Além disso, o selênio preto é ligeiramente solúvel em sulfeto de carbono. Quando essa solução é aquecida a 180 ºC, precipita o selênio cinza, seu alótropo mais estável e denso..
O selênio cinza é resistente à oxidação e é inerte à ação de ácidos não oxidantes. A principal propriedade desse selênio é a fotocondutividade. Quando iluminado, sua condutividade elétrica aumenta por um fator de 10 a 15 vezes.
Reatividade
O selênio em seus compostos existe nos estados de oxidação -2, +4 e +6. Ele mostra uma tendência clara para formar ácidos nos estados de oxidação mais elevados. Os compostos que possuem selênio com estado de oxidação -2 são chamados de selenídeos (Sedois-).
Reação com hidrogênio
O selênio reage com o hidrogênio para formar seleneto de hidrogênio (HdoisSe), um gás incolor, inflamável e malcheiroso.
Reação com oxigênio
O selênio queima emitindo uma chama azul e formando dióxido de selênio:
eu sei8 (s) + 8 Odois => 8 SeOdois (s)
O óxido de selênio é uma substância polimérica sólida, branca. Sua hidratação produz ácido selenioso (HdoisSeO3) Também o selênio forma trióxido de selênio (SeO3), análogo ao enxofre (SO3).
Reação com halogênios
O selênio reage com o flúor para formar hexafluoreto de selênio:
eu sei8 (s) + 24 Fdois (g) => 8 SeF6 (eu)
O selênio reage com cloro e bromo para formar dicloreto de disilênio e dibrometo, respectivamente:
eu sei8 (s) + 4 Cldois => 4 SedoisCldois
eu sei8 (s) + 4 Brdois => 4 SedoisBrdois
O selênio também pode formar SeF4 e SeCl4.
Por outro lado, o selênio forma compostos nos quais um átomo de selênio se junta a um átomo de halogênio e outro de oxigênio. Um exemplo importante é o oxicloreto de selênio (SeOdoisCldois), com selênio no estado de oxidação +6, um solvente extremamente poderoso.
Reação com metais
O selênio reage com os metais para formar selenetos de alumínio, cádmio e sódio. A equação química abaixo corresponde àquela para a formação do seleneto de alumínio:
3 Se8 + 16 Al => 8 Aldoiseu sei3
Selenitas
O selênio forma sais conhecidos como selenitos; por exemplo: selenito de prata (AgdoisSeO3) e selenito de sódio (NadoisSeO3) Este nome tem sido usado, em um contexto literário, para se referir aos habitantes da Lua: os Selenitas.
Ácidos
O ácido mais importante no selênio é o ácido selênico (HdoisSeO4) É tão forte quanto o ácido sulfúrico e é mais facilmente reduzido.
Estrutura e configuração eletrônica
- Selenium e seus links
O selênio possui seis elétrons de valência, por isso está localizado no grupo 16, igual ao oxigênio e ao enxofre. Esses seis elétrons estão nos orbitais 4s e 4p, de acordo com sua configuração eletrônica:
[Ar] 3d10 4sdois 4p4
Portanto, ele precisa, como o enxofre, formar duas ligações covalentes para completar seu octeto de valência; embora tenha disponibilidade de seus orbitais 4d para se ligar a mais de dois átomos. Assim, três átomos de selênio se juntam e formam duas ligações covalentes: Se-Se-Se.
O selênio com sua massa atômica mais elevada tem uma tendência natural para formar estruturas governadas por ligações covalentes; em vez de ser arranjado como moléculas diatômicas Sedois, Se = Se, análogo a Odois, O = O.
- Anéis ou correntes
Dentre as estruturas moleculares que os átomos de selênio adotam, duas podem ser mencionadas em termos gerais: anéis ou cadeias. Observe que no caso hipotético de Se3, os átomos de Se nas extremidades ainda requerem elétrons; portanto, eles devem estar ligados a outros átomos, em sucessão, até que a cadeia possa ser fechada em um anel.
Os anéis mais comuns são os anéis de oito membros ou átomos de selênio:8 (uma coroa de selenito). Por que oito? Porque quanto menor o anel, mais estresse ele sofrerá; ou seja, os ângulos de suas ligações desviam dos valores naturais definidos por suas hibridizações sp3 (semelhante ao que ocorre com cicloalcanos).
Como são oito átomos, a separação entre os átomos Se-Se é suficiente para que suas ligações sejam "relaxadas" e não "dobradas"; embora o ângulo de seus links seja 105,7º e não 109,5º. Por outro lado, pode haver anéis menores:6 e sei7.
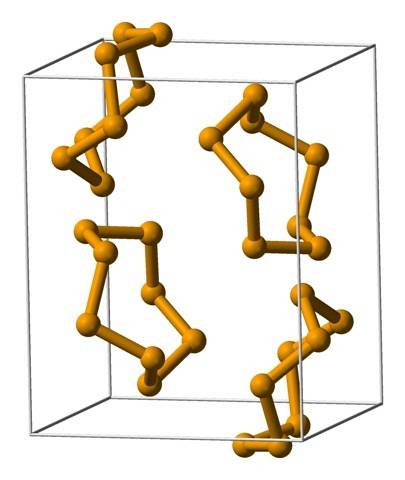
A imagem superior mostra as unidades do Se ring.8. Observe a semelhança que eles têm com as coroas de enxofre; só eles são maiores e mais pesados.
Além dos anéis, os átomos de selênio também podem ser dispostos em cadeias helicoidais (pense em escadas em espiral):
Em suas extremidades pode haver ligações duplas terminais (-Se = Se), ou anéis de Se8.
- Alótropos
Levando em consideração que podem existir anéis helicoidais ou cadeias de selênio, e que suas dimensões também podem variar dependendo do número de átomos que contêm, então é evidente que existe mais de um alótropo para este elemento; isto é, sólidos de selênio puro, mas com diferentes estruturas moleculares.
Selênio vermelho
Entre os alótropos mais proeminentes de selênio temos o vermelho, que pode aparecer como um pó amorfo ou como cristais monoclínicos e polimórficos (ver imagem de Se8).
No selênio vermelho amorfo, as estruturas são desordenadas, sem padrões aparentes; enquanto na lente, os anéis estabelecem uma estrutura monoclínica. O selênio cristalino vermelho é polimórfico, apresentando três fases: α, β e γ, que diferem em suas densidades..
Selênio preto
A estrutura do selênio preto também consiste em anéis; mas não de oito membros, mas de muitos mais, alcançando até anéis de mil átomos (Se1000) Diz-se então que sua estrutura é complexa e consiste em anéis poliméricos; alguns maiores ou menores do que outros.
Como existem anéis poliméricos de tamanhos diferentes, é difícil esperar que eles estabeleçam uma ordem estrutural; então o selênio preto também é amorfo, mas em contraste com o pó avermelhado mencionado acima, ele tem texturas vítreas, embora seja quebradiço.
Selênio cinza
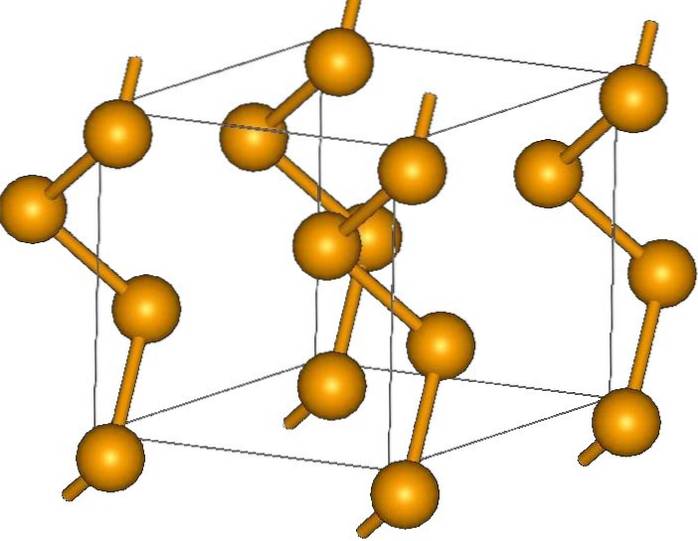
E, por fim, dos alótropos mais simples do selênio é o cinza, que se destaca dos demais por ser o mais estável em condições normais, e também por ter uma aparência metálica..
Seus cristais podem ser hexagonais ou trigonais, estabelecidos pelas forças de dispersão de London entre suas cadeias helicoidais poliméricas (imagem superior). O ângulo de suas ligações é de 130,1º, o que indica um desvio positivo do entorno tetraédrico (com ângulos de 109,5º)..
É por isso que as cadeias helicoidais de selênio dão a impressão de serem "abertas". A título de esclarecimento, nesta estrutura os átomos ficam frente a frente, então em teoria deve haver uma sobreposição maior de seus orbitais para criar faixas de condução.
O calor com o aumento das vibrações moleculares danifica essas bandas quando as cadeias se desordenam; enquanto a energia de um fóton afeta diretamente os elétrons, estimulando-os e promovendo suas transações. Desse ponto de vista, é “fácil” imaginar a fotocondutividade do selênio cinza..
Onde está localizado e produção
Embora amplamente distribuído, o selênio é um elemento raro. É encontrada em seu estado nativo associada a enxofre e minerais como eucairita (CuAgSe), claustalita (PbSe), naumanita (AgdoisSe), e crookesita [(CuTiAg)doisEu sei].
O selênio é encontrado como uma impureza que substitui o enxofre em uma pequena porção dos minerais sulfurosos dos metais; como cobre, chumbo, prata, etc..
Existem solos nos quais o selênio existe na forma solúvel de selenatos. Estes são transportados pela água da chuva para os rios e de lá para o oceano.
Algumas plantas são capazes de absorver e concentrar o selênio. Por exemplo, uma xícara de castanha do Brasil contém 544 µg de selênio, quantidade que equivale a 777% da quantidade diária recomendada de selênio..
Nos seres vivos, o selênio é encontrado em alguns aminoácidos, como: selenometionina, selenocisteína e metilselenocisteína. Selenocisteína e selenito são reduzidos a seleneto de hidrogênio.
Eletrólise de cobre
Não há mineração de selênio. A maior parte é obtida como subproduto do processo de refino da eletrólise do cobre, sendo encontrada no lodo que se acumula no ânodo..
A primeira etapa é a produção de dióxido de selênio. Para isso, o lodo anódico é tratado com carbonato de sódio para produzir sua oxidação. Em seguida, a água é adicionada ao óxido de selênio e é acidificada para formar o ácido de selênio..
Finalmente, o ácido selenioso é tratado com dióxido de enxofre para reduzi-lo e obter selênio elementar..
Em outro método na mistura de lodo e lama formada na produção de ácido sulfúrico, um selênio vermelho impuro é obtido que se dissolve em ácido sulfúrico..
O ácido selênio e o ácido selênico são então formados. Este ácido de selênio recebe o mesmo tratamento que o método anterior.
O cloro, que atua sobre os selenetos metálicos, também pode ser usado para produzir compostos voláteis de selênio clorado; tais como: SedoisCldois, SeCl4, SeCldois e SeOCldois.
Esses compostos, em um processo realizado em água, são convertidos em ácido selenioso, que é tratado com dióxido de enxofre para liberar o selênio..
Papel biológico
Deficiência
O selênio é um oligoelemento essencial para plantas e animais, cuja deficiência em humanos causou doenças graves como a doença de Keshan; uma doença caracterizada por danos ao miocárdio.
Além disso, a deficiência de selênio está associada à infertilidade masculina e pode desempenhar um papel na doença de Kashin-Beck, um tipo de osteoartrite. Além disso, a deficiência de selênio foi observada na artrite reumatóide.
Cofator de enzima
O selênio é um componente de enzimas com ação antioxidante, como a glutationa peroxidase e a tiorredoxina redutase, que atuam na eliminação de substâncias com oxigênio reativo..
Além disso, o selênio é um cofator das desiodinases do hormônio tireoidiano. Essas enzimas são importantes na regulação do funcionamento dos hormônios da tireoide..
O uso de selênio foi relatado no tratamento da doença de Hasimoto, uma doença autoimune com formação de anticorpos contra células da tireoide..
O selênio também tem sido usado para reduzir os efeitos tóxicos do mercúrio, já que algumas de suas ações são exercidas sobre enzimas antioxidantes dependentes de selênio..
Proteínas e aminoácidos
O homem possui cerca de 25 selenoproteínas que exercem ação antioxidante de proteção contra o estresse oxidativo, iniciado por um excesso de espécies reativas de oxigênio (ROS) e de espécies reativas de nitrogênio (NOS)..
A presença dos aminoácidos selenomethiocina e selenocisteína foi detectada em humanos. A selenometionina é usada como suplemento dietético no tratamento de estados de deficiência de selênio.
Riscos
Uma alta concentração corporal de selênio pode ter inúmeros efeitos prejudiciais à saúde, começando com cabelos quebradiços e unhas quebradiças, a erupções cutâneas, calor, edema da pele e dores intensas.
Ao tratar o selênio em contato com os olhos, as pessoas podem sentir queimação, irritação e lacrimejamento. Enquanto isso, a exposição prolongada à fumaça com alto teor de selênio pode causar edema pulmonar, hálito de alho e bronquite..
Além disso, a pessoa pode ter pneumonite, náusea, calafrios, febre, dor de garganta, diarreia e hepatomegalia..
O selênio pode interagir com outros medicamentos e suplementos dietéticos, como antiácidos, antineoplásicos, corticosteróides, niacina e pílulas anticoncepcionais..
O selênio foi associado a um risco aumentado de câncer de pele. Um estudo do National Cancer Institute descobriu que os homens com um alto nível de selênio no corpo tinham duas vezes mais chances de sofrer de câncer de próstata agressivo.
Um estudo indica que a ingestão diária de 200 µg de selênio aumenta a possibilidade de desenvolver diabetes tipo II em 50%.
Formulários
Cosméticos
O sulfeto de selênio é usado no tratamento de seborreia, bem como em cabelos oleosos ou com caspa.
Doutores
É usado como medicina alternativa no tratamento da doença de Hasimoto, uma doença auto-imune da tireóide.
O selênio reduz a toxicidade do mercúrio, uma de suas atividades tóxicas é exercida sobre as enzimas desoxidantes, que utilizam o selênio como cofator.
Eletrólise de manganês
O uso do óxido de selênio na eletrólise do manganês reduz consideravelmente os custos da técnica, pois diminui o consumo de energia elétrica..
Pigmento
O selênio é usado como pigmento em tintas, plásticos, cerâmicas e vidro. Dependendo do selênio usado, a cor do vidro varia do vermelho profundo ao laranja claro..
Fotocondutor
Devido à propriedade do selênio cinza de alterar sua condutividade elétrica em função da intensidade da luz que o irradia, o selênio tem sido utilizado em fotocopiadoras, fotocélulas, fotômetros e células solares..
O uso de selênio em fotocopiadoras foi uma das principais aplicações do selênio; mas o aparecimento de fotocondutores orgânicos vem diminuindo seu uso.
Cristais
O selênio é usado para descolorir os vidros, devido à presença de ferro que produz uma coloração verde ou amarela. Além disso, permite uma coloração vermelha do vidro, dependendo do uso que se deseja dar..
Vulcanização
O selênio dietilditiocarbonato é usado como um agente de vulcanização em produtos de borracha.
Ligas
O selênio é usado em combinação com o bismuto no latão para substituir o chumbo; Elemento muito tóxico que vem diminuindo seu uso devido às recomendações de órgãos de saúde..
O selênio é adicionado em baixas concentrações ao aço e ligas de cobre para melhorar a usabilidade desses metais..
Retificadores
Os retificadores de selênio começaram a ser usados em 1933 até a década de 1970, quando foram substituídos pelo silício devido ao seu baixo custo e qualidade superior..
Referências
- Royal Australian Chemical Institute. (2011). Selênio. [PDF]. Recuperado de: raci.org.au
- Wikipedia. (2019). Selênio. Recuperado de: en.wikipedia.org
- Sato Kentaro. (s.f.). Novos alótropos dos elementos do grupo principal. [PDF]. Recuperado de: tcichemicals.com
- Dr. Dough Stewart. (2019). Fatos sobre o elemento selênio. Chemicool. Recuperado de: chemicool.com
- Robert C. Brasted. (28 de agosto de 2019). Selênio. Encyclopædia Britannica. Recuperado de: britannica.com
- Marques Miguel. (s.f.). Selênio. Recuperado de: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (03 de julho de 2019). Fatos sobre o selênio. Recuperado de: Thoughtco.com
- Lenntech B. V. (2019). Tabela periódica: selênio. Recuperado de: lenntech.com
- Tinggi U. (2008). Selênio: seu papel como antioxidante na saúde humana. Saúde ambiental e medicina preventiva, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Escritório de suplementos dietéticos. (9 de julho de 2019). Selênio: Folha de dados para profissionais de saúde. Instituto Nacional de Saúde. Recuperado de: ods.od.nih.gov

Ainda sem comentários