
Estrutura química do Pentanon, propriedades, síntese, usos
O pentanona é um composto orgânico, pertencente à família das cetonas, cuja fórmula química é C5H10O. É ainda uma das cetonas mais simples e consiste em um líquido incolor com aroma semelhante ao da acetona. Deste ponto em diante, com relação ao número de carbono de seu esqueleto, as cetonas apresentam isomeria de posição.
Ao falar sobre isomeria de posição, refere-se a onde está o grupo carbonila, C = O. Assim, a pentanona na verdade consiste em dois compostos com propriedades físicas ligeiramente diferentes entre si: 2-pentanona e 3-pentanona (imagem inferior). Ambos são líquidos, mas seus pontos de ebulição são os mesmos, portanto, não podem ser separados por destilação..
No entanto, cada um dos dois pentanones tem sua própria rota sintética, portanto, é improvável que haja uma mistura deles; mistura que pode ser viável para separar por congelamento.
Seus usos são especialmente restritos como solventes orgânicos; alternativas à acetona em ambientes onde ela é usada em uma temperatura superior ao seu baixo ponto de ebulição. Da mesma forma, são materiais de partida para outras sínteses orgânicas, uma vez que seu grupo C = O pode ser reduzido ou sofrer adição nucleofílica..
Índice do artigo
- 1 Estrutura química
- 1.1 Isômeros de posição
- 1.2 Interações intermoleculares
- 1.3 Cristais
- 2 propriedades
- 2.1 Aparência física
- 2,2 massa molar
- 2.3 Densidade
- 2.4 Ponto de fusão
- 2,5 ponto de ebulição
- 2.6 Solubilidade em água
- 2.7 Pressão de vapor
- 2.8 ponto de fulgor
- 2.9 Estabilidade
- 3 Síntese
- 3,1 2-pentanona
- 3,2 3-pentanona
- 4 usos
- 5 referências
Estrutura química
Isômeros de posição
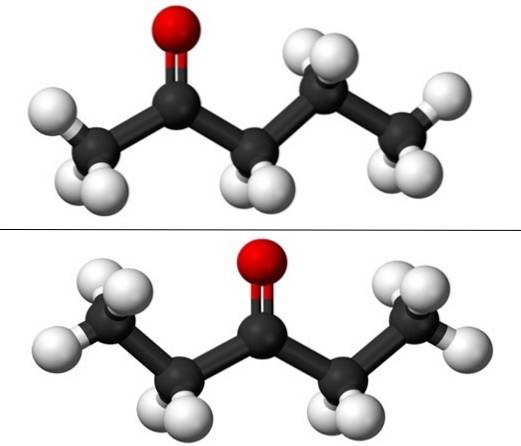
Na imagem temos as estruturas moleculares dos dois isômeros posicionais da pentanona, representadas por um modelo de esferas e barras. As esferas pretas correspondem aos esqueletos de carbono, as brancas aos átomos de hidrogênio e as vermelhas aos átomos de oxigênio do grupo C = O..
2-pentanona
A 2-pentanona (acima) tem o grupo C = O no segundo carbono, que é equivalente ao se estivesse no quarto; ou seja, 2-pentanona e 4-pentanona são equivalentes, pois basta girá-los 180º para que suas estruturas sejam as mesmas.
À esquerda de C = O está um radical metil, CH3-, e à sua direita, um radical propil. É por isso que essa cetona também é chamada (menos comumente usada) de metil propil cetona (MPK). Você pode ver a assimetria dessa estrutura à primeira vista.
3-pentanona
3-pentanona (abaixo) tem o grupo C = O no terceiro carbono. Observe que este isômero é uma versão maior da acetona e também é muito simétrico; os dois radicais nas laterais do grupo C = O são iguais: dois radicais etil, CH3CHdois-. É por isso que a 3-pentanona também é chamada de dietil cetona (ou dimetil acetona).
Interações intermoleculares
A presença do grupo carbonila, tanto na 2-pentanona quanto na 3-pentanona, confere polaridade à molécula.
Portanto, ambos os isômeros da pentanona são capazes de interagir entre si por meio de forças dipolo-dipolo, em que a maior densidade de carga negativa, δ-, vista em um mapa de potencial eletrostático, será orientada em torno do átomo de oxigênio..
Da mesma forma, as forças de dispersão de Londres intervêm em um grau menor entre os esqueletos carbonizados e hidrogenados..
Como a pentanona tem maior área molecular e massa em relação à acetona, essa contribuição aumenta seu momento de dipolo e permite que ela tenha um ponto de ebulição mais alto (102 ºC> 56 ºC). Na verdade, os dois isômeros vaporizam a 102 ° C; enquanto congela em diferentes temperaturas.
Cristais
Provavelmente simetrias desempenham um papel importante na cristalização. Por exemplo, o ponto de fusão da 2-pentanona é -78 ºC, enquanto o da 3-pentanona, -39 ºC.
Isso significa que os cristais de 3-pentanona são mais estáveis em relação à temperatura; suas moléculas são mais coesas e requerem mais calor para se separarem na fase líquida.
Se houvesse uma mistura de ambos os isômeros, a 3-pentanona seria a primeira a cristalizar, a 2-pentanona sendo a última em uma temperatura mais baixa. As moléculas de 3-pentanona mais simétricas orientam-se mais facilmente do que as de 2-pentanona: assimétricas e ao mesmo tempo mais dinâmicas.
Propriedades
Aparência física
Líquidos incolores com aroma semelhante a acetona.
Massa molar
86,13 g / mol
Densidade
0,81 g / mL (3-pentanona)
0,809 g / mL (2-pentanona)
Ponto de fusão
-78 ºC (2-pentanona)
-39 ºC (3-pentanona)
Ponto de ebulição
102 ºC (para ambos os isômeros)
Solubilidade em água
35 g / L (3-pentanona)
60 g / L (2-pentanona)
Pressão de vapor
35 mmHg (3-pentanona)
270 mmHg (2-pentanona) a 20 ° C
Esses valores não são úteis para comparar diretamente as pressões de vapor de ambos os isômeros, uma vez que o primeiro é relatado sem a temperatura na qual foi medido..
Ponto de inflamação
12,78 ° C (3-pentanona)
10 ºC (2-pentanona)
Estabilidade
Os dois isômeros da pentanona são extremamente inflamáveis, portanto, devem ser mantidos o mais longe possível de qualquer fonte de calor. Os pontos de inflamação indicam que uma chama pode inflamar os vapores de ambas as pentanonas mesmo a uma temperatura de 10ºC..
Síntese
Embora os dois isômeros da pentanona sejam física e quimicamente muito semelhantes, suas rotas sintéticas são independentes uma da outra, por isso é improvável que ambas sejam obtidas na mesma síntese..
2-pentanona
Partindo do reagente 2-pentanol, um álcool secundário, ele pode ser oxidado a 2-pentanona usando ácido hipocloroso formado in situ, HClO, como agente oxidante. A oxidação seria:
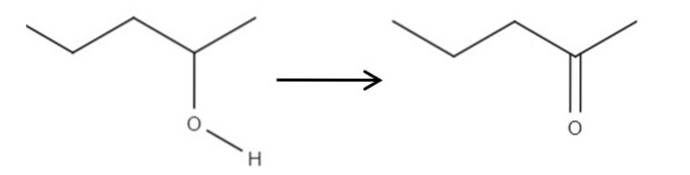
Simplesmente a ligação C-OH torna-se C = O. Existem outros métodos para sintetizar a 2-pentanona, mas de todos este é o mais fácil de entender..
3-pentanona
3-pentanona pode ser sintetizada por descarboxilação cetônica de ácido propanóico, CH3CHdoisCOOH. Esta rota sintética produz cetonas simétricas e consiste em uma molécula de CH3COOH perderá o grupo COOH como COdois, enquanto o outro é o grupo OH na forma de HdoisOU:
2CH3CHdoisCOOH => CH3CHdoisCarrodoisCH3 + COdois + HdoisOU
Outra via um pouco mais complexa é reagir diretamente uma mistura de etileno, CHdois= CHdois, COdois e Hdois para formar 3-pentanona.
Formulários
A menos que a aplicação seja muito rigorosa, seja uma síntese específica, ou também tenha sido demonstrado que os dois isômeros não produzem os mesmos resultados, é irrelevante escolher entre usar 2-pentanona ou 3-pentanona em qualquer um de seus usos..
Ou seja, "não importa" se você quer usar a 2-pentanona ou a 3-pentanona como solvente para tintas ou resinas, ou ainda como desengraxante, já que os critérios mais importantes serão o preço e a disponibilidade. 3-pentanona é usada na indústria automotiva para estudar o comportamento de gases em motores de combustão interna.
Referências
- Morrison, R. T. e Boyd, R, N. (1987). Quimica Organica. 5ª Edição. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10ª edição). Wiley plus.
- Wikipedia. (2019). 3-pentanona. Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). 2-Pentanona. Banco de dados PubChem. CID = 7895. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2019). 3-pentanona. Recuperado de: chemspider.com
- Professor T. Nalli. (2013). Oxidação do 2-pentanol e destilação do produto. Recuperado de: course1.winona.edu



Ainda sem comentários