
Estrutura, propriedades, usos, riscos do nitrito de sódio (NaNO2)

O nitrito de sódio é um sólido inorgânico cristalino formado por um íon sódio Na+ e um íon nitrito NOdois-. Sua fórmula química é NaNOdois. É um sólido cristalino branco que tende a absorver água do meio ambiente, ou seja, é higroscópico.
Na presença de ar, oxida lentamente em nitrato de sódio NaNO3. Possui propriedades oxidantes (oxida outros compostos) e também propriedades redutoras (é oxidado por outros compostos).

Está presente no corpo humano naturalmente e é usado como conservante para carnes curadas e peixes defumados, pois previne o crescimento de microrganismos nocivos.
Tem importante utilização no tratamento emergencial de intoxicações por cianeto, pois reduz o efeito tóxico e letal desse composto. No entanto, deve ser administrado com muito cuidado e não funciona em todos os casos.
Verificou-se que pode prevenir infecções oculares causadas pela contaminação de lentes de contato por microorganismos. Alguns estudos indicam que seu consumo com alimentos pode causar câncer, mas estima-se que isso possa ser evitado pela ingestão de vitamina C com esses alimentos.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Solubilidade
- 3,7 pH
- 3.8 Outras propriedades
- 4 Obtendo
- 4.1 Presença no corpo
- 5 usos
- 5.1 Na indústria de alimentos
- 5.2 Como tratamento de emergência em envenenamento por cianeto
- 5.3 Para dilatação dos vasos sanguíneos
- 5.4 Contra alguns parasitas
- 5.5 Para evitar danos aos órgãos
- 5.6 Para evitar infecções devido ao uso de lentes de contato
- 5.7 Em vários usos
- 6 riscos ou inconveniências
- 7 referências
Estrutura
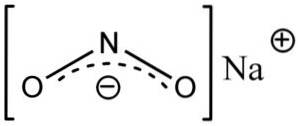
O nitrito de sódio é composto pelo cátion Na de sódio+ e o ânion nitrito NOdois-.
No ânion nitrito, NOdois- o nitrogênio tem uma valência de +3 e o oxigênio de -2, por esta razão o ânion tem uma única carga global negativa.
Ânion nitrito NÃOdois- tem uma estrutura angular, ou seja, as ligações de nitrogênio (N) com átomos de oxigênio (O) formam um ângulo.
Nomenclatura
- Nitrito de sódio
- Nitrito de sódio
- Sal de sódio de ácido nitroso.
Propriedades
Estado físico
Sólido cristalino branco-amarelado. Cristais ortorrômbicos.
Peso molecular
68,995 g / mol
Ponto de fusão
271 ºC
Ponto de ebulição
Não ferve. Ele se decompõe acima de 320 ºC
Densidade
2,17 g / cm3 a 20 ºC
Solubilidade
Solúvel em água: 84,8 g / 100 g de água a 25 ºC. Ligeiramente solúvel em etanol. Moderadamente solúvel em metanol. Moderadamente solúvel em éter dietílico.
pH
Suas soluções aquosas são alcalinas, com um pH de aproximadamente 9. Isso ocorre porque o ácido nitroso é um ácido fraco que tende a não se dissociar, então o íon NOdois- tente pegar um próton H+ de água para formar HNOdois, que leva à formação de íons OH- que produzem alcalinidade.
NÃOdois- + HdoisO → HNOdois + Oh-
Outras propriedades
Nitrito de sódio NaNOdois na presença de ar oxida lentamente em nitrato de sódio NaNO3. É um sólido higroscópico, pois absorve água do meio ambiente.
Tem propriedades oxidantes (pode oxidar outros compostos) e também propriedades redutoras (pode ser oxidado por outros compostos).
Se entrar em contato com materiais como madeira, papel ou têxteis, pode causar um incêndio perigoso..
Com os ácidos ocorre sua decomposição, gerando uma mistura de gases tóxicos marrons de óxidos de nitrogênio (NOx).
Obtendo
Pode ser obtido por aquecimento de nitrato de sódio NaNO3 com chumbo Pb:
Irmão mais velho3 + Pb → NaNOdois + PbO
Presença no corpo
O ânion nitrito está naturalmente presente no sangue e nos tecidos, pois é formado pela oxidação do NO..
Formulários
Na industria alimentícia
É utilizado para marinar carnes, pois atua como agente de retenção de cor e sabor, e como conservante, pois controla o crescimento de microrganismos, evitando principalmente o desenvolvimento de Clostridium botulinum causando doença de botulismo.
O nitrito de sódio nas carnes reage com a hemoglobina nos glóbulos vermelhos ou nos glóbulos vermelhos deste alimento. Também usado em peixes defumados curados.

Como tratamento de emergência para envenenamento por cianeto
O nitrito de sódio é usado para tratar o envenenamento agudo por cianeto. É um antídoto para este problema sério.
Sua ação se deve ao fato de favorecer a formação de metemoglobina (um tipo de hemoglobina) no sangue, que aprisiona os íons cianeto e não os libera, evitando que sejam liberados nas células, tornando-os menos tóxicos.
Em caso de envenenamento por cianeto, o nitrito de sódio é aplicado por via intravenosa, levando cerca de 12 minutos para gerar metemoglobina. Apesar dessa demora, também oferece proteção devido ao seu efeito vasodilatador..
Para a dilatação dos vasos sanguíneos
É usado no tratamento da hipertensão arterial pulmonar, pois atua dilatando os vasos sanguíneos, reduzindo assim a pressão arterial. Estima-se que esse efeito se deva ao fato de se transformar em óxido nítrico NO que atua relaxando os músculos moles..
No entanto, as causas de sua eficácia ainda estão em estudo..
Contra alguns parasitas
Certos pesquisadores descobriram que o nitrito de sódio inibe o crescimento e a multiplicação do parasita intestinal Blastocystis hominis mesmo que seja resistente a outros medicamentos.
NaNO foi encontradodois gera a morte desse parasita por apoptose, que é uma espécie de suicídio da célula do parasita. O nitrito de sódio faz com que as células intestinais produzam NO, o que parece ser importante neste processo.
Para evitar danos aos órgãos
De acordo com alguns estudos, o nitrito é um poderoso inibidor de danos ao coração e ao fígado em processos isquêmicos (diminuição do fluxo sanguíneo em uma parte do corpo). Acredita-se que isso se deva ao fato de ser uma reserva biológica de NO.
Concluiu-se que pode ser usado para prevenir danos a órgãos após restaurar o fluxo sanguíneo que foi interrompido por um ataque cardíaco, cirurgia abdominal de alto risco ou um transplante de órgão..
Para evitar infecções pelo uso de lentes de contato
NaNO foi encontradodois evita a formação de filmes de microrganismos patogênicos Staphylococcus aureus Y Pseudomonas aeruginosa sobre lentes de contato.

Em vários usos
O nitrito de sódio é usado para fazer corantes, medicamentos e vários compostos orgânicos.
Também serve como um inibidor de corrosão em graxas multiuso.
Riscos ou inconvenientes
Um dos problemas do uso de nitrito de sódio para intoxicações por cianeto é que ele causa sérios distúrbios cardiovasculares em crianças..
Não recomendado para vítimas de incêndio onde ocorre exposição simultânea a cianeto e monóxido de carbono (CO). O CO reduz a capacidade do sangue de transportar oxigênio, portanto, a administração de NaNOdois agravaria a condição de baixo oxigênio no sangue do paciente.
O nitrito de sódio inalado é irritante e tóxico, podendo causar danos ao sistema cardiovascular e ao sistema nervoso central. Além disso, é prejudicial ao meio ambiente.
O nitrito de sódio ingerido com os alimentos pode ser prejudicial. O nitrito, ao chegar ao estômago, reage com certos compostos formando nitrosaminas, que podem causar câncer.
Essas reações podem ser evitadas na presença de vitamina C.
De acordo com algumas fontes consultadas, o risco de consumir nitritos com carnes curadas ou peixes é mínimo porque o nitrito está naturalmente presente na saliva.
As fontes indicam que este risco também é mínimo em comparação com os grandes benefícios de consumir alimentos livres de microorganismos nocivos..
Referências
- Bhattacharya, R. e Flora, S.J.S. (2015). Toxicidade de cianeto e seu tratamento. Em Handbook of Toxicology of Chemical Warfare Agents (Segunda Edição). Recuperado de sciencedirect.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Nitrito de sódio. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). A eficácia antibiofilme do óxido nítrico em lentes de contato gelatinosas. BMC Ophthalmol 17, 206 (2017). Recuperado de bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, G. (2003). Antioxidantes. Antioxidantes Sintéticos. Na Enciclopédia de Ciências Alimentares e Nutrição (segunda edição). Recuperado do sciencedirect.
- Barozzi Seabra, A. e Durán, N. (2017). Doadores de óxido nítrico para o tratamento de doenças negligenciadas. Em doadores de óxido nítrico. Recuperado de sciencedirect.com.
- Duranski, M.R. et al. (2005). Efeitos citoprotetores do nitrito durante a isquemia-reperfusão in vivo do coração e do fígado. J Clin Invest 2005; 115 (5): 1232-1240. Recuperado de ncbi.nlm.nih.gov.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.



Ainda sem comentários