
História do direito de Boyle-Mariotte, expressão, exemplos
A lei de Boyle-Mariotte É aquele que expressa a relação entre a pressão exercida por ou sobre um gás e o volume que ele ocupa; mantendo a temperatura do gás constante, bem como a sua quantidade (número de moles).
Esta lei, juntamente com a de Charles, Gay-Lussac, Charles e Avogadro, descreve o comportamento de um gás ideal; especificamente, em um recipiente fechado sujeito a mudanças de volume exercidas por uma força mecânica.
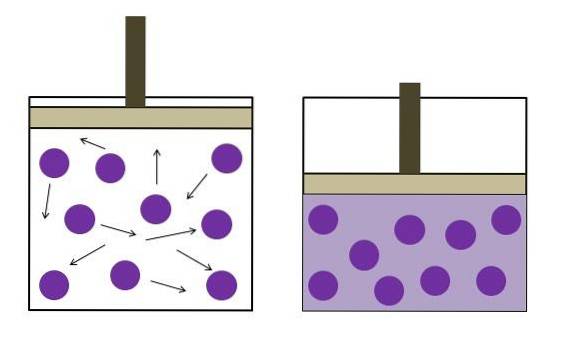
A imagem acima resume brevemente a lei Boyle-Mariotte.
Os pontos roxos representam moléculas de gás ou átomos, que colidem com as paredes internas do recipiente (esquerda). Conforme o espaço disponível ou volume do recipiente ocupado por este gás diminui, as colisões aumentam, o que se traduz em um aumento da pressão (direita).
Isso mostra que a pressão P e o volume V do gás são inversamente proporcionais se o recipiente estiver hermeticamente fechado; caso contrário, uma pressão mais alta seria igual a uma maior expansão do vaso.
Se fosse feito um gráfico V contra P, com os dados de V e P nos eixos Y e X, respectivamente, uma curva assintótica seria observada. Quanto menor V, maior é o aumento em P; ou seja, a curva se estenderá em direção a altos valores de P no eixo X.
Claro, a temperatura permanece constante; mas, se o mesmo experimento fosse realizado em temperaturas diferentes, as posições relativas dessas curvas V vs P mudariam no eixo cartesiano. A mudança seria ainda mais evidente se fosse plotada em um eixo tridimensional, com T constante no eixo Z..
Índice do artigo
- 1 História da Lei de Boyle
- 1.1 Antecedentes
- 1.2 Experimento de Mercúrio
- 1.3 Edme Mariotte
- 1.4 Fortalecimento da lei
- 2 O que é essa lei?
- 3 Expressão matemática
- 4 Para que serve? Que problemas a lei de Boyle resolve?
- 4.1 Motores a vapor
- 4.2 Bebericando
- 4.3 Sistema respiratório
- 5 exemplos (experimentos)
- 5.1 Experimento 1
- 5.2 Experimento 2
- 6 referências
História da Lei de Boyle
Fundo
Desde que o cientista Galileo Galilei expressou sua crença na existência de um vácuo (1638), os cientistas começaram a estudar as propriedades do ar e dos vazios parciais..
O químico anglo-irlandês Robert Boyle começou seu estudo das propriedades do ar em 1638 ao saber que Otto von Guericke, um engenheiro e físico alemão, havia construído uma bomba de ar..
Experimento de mercúrio
Para conduzir seus estudos de pressão do ar, Boyle usou um tubo de vidro em forma de “J”, cuja construção foi atribuída a Robert Hooke, um assistente de Boyle. A extremidade do braço curto foi selada, enquanto a extremidade do braço longo do tubo foi aberta para colocar o mercúrio.
Desde o início, Boyle queria estudar a elasticidade do ar, qualitativa e quantitativamente. Ao derramar mercúrio pela extremidade aberta do tubo “J”, Boyle deduziu que o ar no braço curto do tubo estava se contraindo sob a pressão do mercúrio..
Resultados
Quanto maior for a quantidade de mercúrio adicionada ao tubo, maior será a pressão exercida no ar e menor será o seu volume. Boyle obteve um gráfico do tipo exponencial negativo do volume de ar em função da pressão.
Enquanto isso, se o volume de ar for plotado contra o inverso da pressão, temos uma linha reta com uma inclinação positiva.
Em 1662, Boyle publicou a primeira lei física dada na forma de uma equação, que indicava a dependência funcional de duas variáveis. Neste caso, a pressão e o volume.
Boyle apontou que havia uma relação inversa entre a pressão exercida sobre um gás e o volume que o gás ocupava, essa relação sendo relativamente verdadeira para gases reais. A maioria dos gases se comporta como gases ideais em temperaturas e pressões moderadas.
À medida que ocorreram pressões mais altas e temperaturas mais baixas, desvios no comportamento dos gases reais em relação aos ideais tornaram-se mais perceptíveis.
Edme Mariotte
O físico francês Edme Mariotte (1620-1684) descobriu independentemente a mesma lei em 1679. Mas teve o mérito de mostrar que o volume varia com a temperatura. Por isso é chamada de Lei de Mariotte ou Lei de Boyle e Mariotte..
Fortalecimento da lei
Daniel Bernoulli (1737) reforçou a Lei de Boyle ao apontar que a pressão de um gás é produzida pelos impactos de partículas de gás nas paredes do recipiente que o contém..
Em 1845, John Waterston publicou um artigo científico, no qual enfocou os princípios fundamentais da teoria cinética dos gases..
Posteriormente, Rudolf Clausius, James Maxwell e Ludqwig Boltzmann consolidaram a teoria cinética dos gases, que relaciona a pressão exercida por um gás com a velocidade das partículas de gás em movimento..
Quanto menor o volume do recipiente que contém o gás, maior será a frequência dos impactos das partículas que o formam contra as paredes do recipiente; e, portanto, quanto maior a pressão exercida pelo gás.
O que é essa lei?
Os experimentos realizados por Boyle indicam que existe uma relação inversa entre o volume ocupado por um gás e a pressão exercida sobre ele. Porém, a relação indicada não é totalmente linear, conforme indicado por um gráfico da variação do volume em função da pressão atribuída a Boyle.
A Lei de Boyle indica que o volume ocupado por um gás é inversamente proporcional à pressão. Também é indicado que o produto da pressão de um gás e seu volume é constante.
Expressão matemática
Para chegar à expressão matemática da lei de Boyle-Mariotte, partimos de:
V ∝ 1 / P
Onde indica que o volume ocupado por um gás é inversamente proporcional à sua pressão. No entanto, há uma constante que determina o quão inversamente proporcional é essa relação.
V = k / P
Onde k é a constante de proporcionalidade. Resolvendo para k, temos:
VP = k
O produto da pressão de um gás e seu volume é constante. Então:
V1P1 = k e VdoisPdois = k
E disso pode-se deduzir que:
V1P1 = VdoisPdois
A última é a expressão final ou equação da lei de Boyle.
Para que serve? Que problemas a lei de Boyle resolve?
Motores a vapor

A Lei Boyle-Mariotte é aplicada na operação de motores a vapor. É um motor de combustão externa que utiliza a transformação da energia térmica de uma quantidade de água em energia mecânica.
A água é aquecida em uma caldeira hermeticamente fechada, e o vapor produzido exerce uma pressão de acordo com a lei de Boyle-Mariote que produz uma expansão de volume de um cilindro ao empurrar um pistão.
O movimento linear do pistão se transforma em movimento rotacional, por meio da utilização de um sistema de bielas e manivelas, que podem movimentar as rodas de uma locomotiva ou o rotor de um gerador elétrico..
Atualmente, a locomotiva a vapor alternativa é um motor pouco utilizado, já que foi substituída pelo motor elétrico e pelo motor de combustão interna nos veículos de transporte..
Sip drinks
A ação de sugar um refrigerante ou suco de uma garrafa por meio de um tubo de plástico está relacionada à lei de Boyle-Mariotte. Quando o ar é sugado para fora do tubo pela boca, há uma diminuição da pressão dentro do tubo.
Essa queda de pressão facilita o movimento ascendente do líquido no tubo, permitindo sua ingestão. Este mesmo princípio funciona na extração de sangue com o uso de uma seringa..
Sistema respiratório
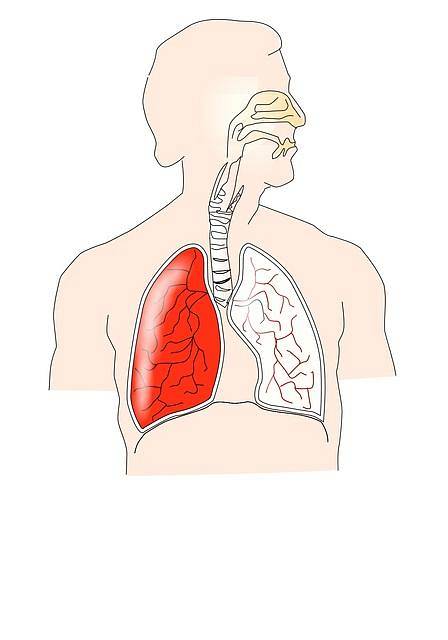
A lei de Boyle-Mariotte está intimamente relacionada ao funcionamento do sistema respiratório. Durante a fase de inspiração, o diafragma e outros músculos se contraem; por exemplo, os intercostais externos que produzem uma expansão da caixa torácica.
Isso causa uma diminuição na pressão intrapleural, causando uma expansão pulmonar que produz um aumento no volume pulmonar. Portanto, a pressão intrapulmonar diminui de acordo com a lei de Boyle-Mariotte.
À medida que a pressão intrapulmonar se torna subatmosférica, o ar atmosférico flui para os pulmões, causando um aumento na pressão pulmonar; assim, igualando sua pressão à pressão atmosférica, e concluindo a fase de inspiração.
Posteriormente, os músculos inspiratórios relaxam e os músculos expiratórios se contraem. Além disso, ocorre a retração pulmonar elástica, fenômeno que produz diminuição do volume pulmonar, com conseqüente aumento da pressão intrapulmonar, explicado pela lei de Boyle-Mariotte..
À medida que a pressão intrapulmonar aumenta e se torna maior que a pressão atmosférica, o ar flui do interior dos pulmões para a atmosfera. Isso ocorre até que as pressões se equalizem, encerrando a fase de expiração..
Exemplos (experimentos)
Experimento 1
Coloca-se um pequeno balão hermeticamente fechado, fazendo um nó em sua boca, dentro de uma seringa, da qual foi retirado o êmbolo, de aproximadamente 20 ml. O êmbolo da seringa é colocado em direção ao meio da seringa, a agulha é retirada e a entrada de ar está obstruída.
Observação
Ao puxar lentamente o êmbolo do injetor, observa-se que o balão infla.
Explicação
Duas pressões são exercidas na parede do balão: uma pressão em sua face interna, produto do ar contido dentro do balão, e outra pressão na face externa do balão, exercida pelo ar contido na seringa..
Puxar o êmbolo do injetor cria um meio vácuo interno. Portanto, a pressão do ar na face externa da parede da bomba diminui, tornando a pressão exercida no interior da bomba relativamente mais alta..
Esta pressão líquida, de acordo com a lei de Boyle-Mariote, produzirá uma distensão da parede do balão e um aumento no volume do balão..
Experimento 2
Uma garrafa de plástico é cortada aproximadamente ao meio, garantindo que o corte seja o mais horizontal possível. Um balão bem ajustado é colocado na boca da garrafa, ao mesmo tempo que uma certa quantidade de água é colocada em um prato fundo.
Observação
Ao colocar o fundo da garrafa com o balão sobre a água do prato, o balão infla moderadamente.
Explicação
A água desloca uma certa quantidade de ar, aumentando a pressão do ar na parede da garrafa e no interior do balão. Isso causa, de acordo com a lei de Boyle-Mariotte, um aumento no volume do balão, que é visualizado pela insuflação do balão..
Referências
- Wikipedia. (2019). Lei de Boyle. Recuperado de: en.wikipedia.org
- Os editores da Encyclopaedia Britannica. (27 de julho de 2018). Lei de Boyle. Encyclopædia Britannica. Recuperado de: britannica.com
- Helmenstine, Todd. (5 de dezembro de 2018). A Fórmula da Lei de Boyle. Recuperado de: Thoughtco.com
- Filmes jovens indianos. (15 de maio de 2018). Lei de Boyle: Experiência Científica para Crianças. Recuperado de: yifindia.com
- Cecilia Bembibre. (22 de maio de 2011). Balão de ar quente. Definição ABC. Recuperado de: definicionabc.com
- Ganong, W., F. (2003). Fisiologia Médica. (19ª edição). Editorial do Manual Moderno.


Ainda sem comentários