
Biografia de Joseph Thomson e contribuições para a ciência e a química
Joseph John Thomson Ele foi um químico notável por várias contribuições, como a descoberta do elétron, seu modelo atômico, a descoberta de isótopos ou o experimento de raios catódicos.
Ele nasceu em Cheetam Hill, um distrito de Manchester, Inglaterra, em 18 de dezembro de 1856. Também conhecido como "J.J." Thomson, estudou engenharia no Owens College, agora parte da Universidade de Manchester, e mais tarde matemática em Cambridge.

Em 1890, J. J. Thomson casou-se com Rose Elizabeth Paget, filha do médico Sir Edward George Paget, com quem teve dois filhos: uma menina, chamada Joan Paget Thomson, e um menino, George Paget Thomson..
Este último se tornaria um cientista famoso, obtendo, em 1937, o Prêmio Nobel de Física por seu trabalho com elétrons..
Desde jovem Thomson focou seus estudos na estrutura dos átomos, descobrindo assim a existência de elétrons e isótopos, entre muitas outras contribuições..
Em 1906, Thomson recebeu o Prêmio Nobel de Física, "em reconhecimento ao grande mérito de suas pesquisas teóricas e experimentais sobre a condução de eletricidade por meio de gases", entre tantos outros prêmios por seu trabalho. (1)
Em 1908, ele foi nomeado cavaleiro pela coroa britânica e serviu como Professor Honorário de Física em Cambridge e no Royal Institute, em Londres..
Morreu em 30 de agosto de 1940, aos 83 anos, na cidade de Cambridge, Reino Unido. O físico foi enterrado na Abadia de Westminster, perto do túmulo de Sir Isaac Newton. (dois)
Índice do artigo
- 1 Principais contribuições da Thomson para a ciência
- 1.1 Descoberta do elétron
- 1.2 Modelo atômico de Thomson
- 1.3 Separação de átomos
- 1.4 Descoberta de isótopos
- 1.5 Experimentos de raios catódicos
- 1.6 Espectrômetro de massa
- 2 O legado de Thomson
- 3 trabalhos notáveis
- 4 referências
Principais contribuições de Thomson para a ciência
Descoberta do elétron
Em 1897, J.J. Thomson descobriu uma nova partícula mais leve do que o hidrogênio, que foi chamada de "elétron".
O hidrogênio foi considerado uma unidade de medida do peso atômico. Até então, o átomo era a menor divisão da matéria.
Nesse sentido, Thomson foi o primeiro a descobrir partículas subatômicas corpusculares carregadas negativamente.
Modelo atômico de Thomson
O modelo atômico de Thomson era a estrutura que o físico inglês atribuía aos átomos. Para o cientista, os átomos eram uma esfera de carga positiva.
Ali os elétrons de carga negativa foram incorporados, uniformemente distribuídos naquela nuvem de carga positiva, ou seja, ela neutraliza a carga positiva da massa do átomo..
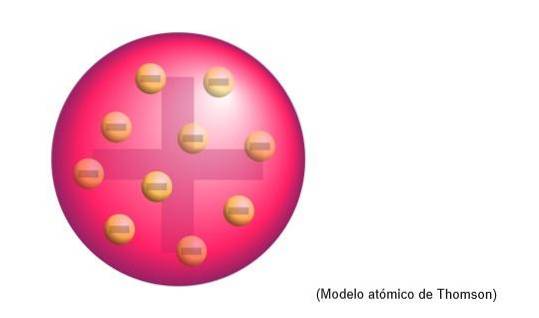
Este novo modelo substitui o desenvolvido por Dalton e mais tarde será refutado por Rutherford, um discípulo de Thomson no Cavendish Laboratories, Cambridge..
Separação de átomos
Thomson usou raios positivos ou anódicos para separar átomos de diferentes massas. Esse método permitiu calcular a eletricidade transportada por cada átomo e o número de moléculas por centímetro cúbico..
Por ser capaz de dividir átomos de diferentes massas e cargas, o físico descobriu a existência de isótopos. Também dessa forma, com seu estudo dos raios positivos, ele deu um grande avanço para a espectrometria de massa..
Descoberta de isótopos
J.J. Thomson descobriu que os íons de néon tinham massas diferentes, ou seja, pesos atômicos diferentes. Foi assim que Thomson mostrou que o neon possui dois subtipos de isótopos, neon-20 e neon-22..
Os isótopos, estudados até hoje, são átomos do mesmo elemento, mas seus núcleos têm números de massa diferentes, uma vez que são compostos de diferentes quantidades de nêutrons em seu centro..
Experimentos de raios catódicos
Os raios catódicos são correntes de elétrons em tubos de vácuo, ou seja, tubos de vidro com dois eletrodos, um positivo e outro negativo..
Quando o eletrodo negativo, ou também chamado de cátodo, é aquecido, ele emite radiação que é direcionada para o eletrodo positivo, ou ânodo, em linha reta se nenhum campo magnético estiver presente naquele caminho.
Se as paredes de vidro do tubo são cobertas com material fluorescente, o impacto dos cátodos contra essa camada produz a projeção de luz.
Thomson estudou o comportamento dos raios catódicos e chegou à conclusão de que os raios viajavam em linha reta.
Além disso, esses raios poderiam ser desviados de seu caminho pela presença de um ímã, ou seja, um campo magnético. Além disso, os raios podiam mover as lâminas com a força da massa dos elétrons circulantes, demonstrando assim que os elétrons tinham massa..
J.J. Thomson experimentou variar o gás dentro do tubo de raios catódicos, mas não alterou o comportamento dos elétrons. Além disso, os raios catódicos aqueciam objetos que ficavam no caminho entre os eletrodos..
Em conclusão, Thomson mostrou que os raios catódicos têm efeitos luminosos, mecânicos, químicos e térmicos..
Os tubos de raios catódicos e suas propriedades de luz foram transcendentais para a invenção subsequente da televisão de tubo (CTR) e das câmeras de vídeo..
Espectrômetro de massa
J.J. Thomson criou uma primeira abordagem para Espectrômetro de massa. Essa ferramenta permitiu ao cientista estudar a relação massa / carga dos tubos de raios catódicos e medir o quanto eles se desviam devido à influência de um campo magnético e a quantidade de energia que carregam..
Com essa pesquisa ele chegou à conclusão de que os raios catódicos eram compostos por corpúsculos carregados negativamente, que estão dentro dos átomos, postulando assim a divisibilidade do átomo e dando origem à figura do elétron..
Da mesma forma, os avanços na espectrometria de massa continuaram até hoje, evoluindo para diferentes métodos para separar elétrons de átomos..
Além disso, Thomson foi o primeiro a sugerir o primeiro guia de ondas em 1893. Este experimento consistia na propagação de ondas eletromagnéticas dentro de uma cavidade cilíndrica controlada, que foi realizada pela primeira vez em 1897 por Lord Rayleigh, outro Prêmio Nobel de Física..
Os guias de onda seriam amplamente usados no futuro, ainda hoje com transmissão de dados e fibra óptica.
O legado de Thomson
O Thomson (Th) foi estabelecido como uma unidade de medida de carga de massa em espectrometria de massa, proposta pelos químicos Cooks e Rockwood, em homenagem a Thomson..
Essa técnica permite determinar a distribuição das moléculas de uma substância de acordo com sua massa e, por meio dela, reconhecer quais estão presentes em uma amostra de matéria..
Fórmula de Thomson (Th):
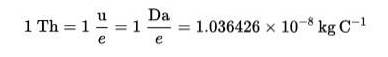
Trabalhos notáveis
- A descarga de eletricidade por meio de gases, condução de eletricidade por meio de gases (1900).
- The Corpuscular Theory of Matter, The Electron in Chemistry and Recollections and Reflections (1907).
- Além do elétron (1928).
Referências
- Nobel Media AB (2014). J. Thomson - Biográfico. Nobelprize.org. nobelprize.org.
- Thomson, Joseph J., Condução de eletricidade através de gases. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. O charme discreto das partículas elementares.
- Christen, Hans Rudolf, Fundamentos de Química Geral e Inorgânica, Volume 1. Barcelona Espanha. Ediciones Reverté S.A., 1986.
- Arzani, Aurora Cortina, Química Elemental Geral. México, Editorial Porrúa, 1967.
- R. G. Cooks, A. L. Rockwood. Rapid Commun. Espectromismo de massa. 5, 93 (1991).



Ainda sem comentários