
Estrutura, propriedades do hipoclorito de potássio (KOCl)
O hipoclorito de potássio É o sal de potássio do ácido hipocloroso. É também um sal ternário de potássio, oxigênio e cloro e constitui um composto inorgânico. Sua fórmula química é KOCl, o que significa que o cátion K é encontrado no sólido iônico.+ e o ânion OCl- em uma razão estequiométrica de 1: 1.
Dos seus compostos homólogos (LiOCl, NaOCl, Ca (OCl)dois) é talvez o menos usado e popularmente conhecido na cultura química e pragmática. Todos esses sais têm o denominador comum do ânion hipoclorito (OCl-), o que lhes confere suas principais características como agente clareador.
A história do hipoclorito de potássio e suas propriedades físico-químicas são semelhantes às do sal de hipoclorito de sódio. Foi inicialmente produzido em 1789 por Claude Louis Berthollet em Javel, Paris. A reação do autor que levou à síntese do referido composto é expressa pela seguinte equação química:
Cldois + 2KOH => KCl + KClO + HdoisOU
De acordo com a equação, o cloro molecular reage com o hidróxido de potássio (ou potássio cáustico), reduzindo e oxidando os átomos de cloro. Isso pode ser verificado comparando o número de oxidação de Cl em KCl (-1) com o de Cl em KClO (+1).
Índice do artigo
- 1 Estrutura química
- 2 Nomenclatura
- 3 propriedades
- 3.1 Massa molar
- 3.2 Aparência
- 3,3 Densidade
- 3.4 Ponto de fusão
- 3.5 Ponto de ebulição
- 3.6 Solubilidade em água
- 3.7 Reatividade
- 4 usos
- 5 referências
Estrutura química

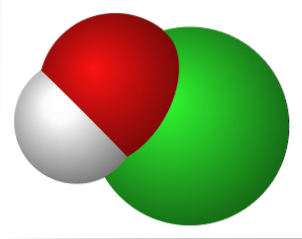
A imagem superior representa as interações eletrostáticas entre o cátion K+ e o ânion OCl- (com oxigênio carregando uma carga formal negativa).
Esses íons têm as mesmas proporções estequiométricas (1: 1) e suas forças não direcionais formam um arranjo cristalino, onde K+ está posicionado o mais próximo do átomo O.
Embora não existam estudos que descrevam o sistema cristalino de KOCl (cúbico, ortorrômbico, monoclínico, etc.), basta visualizá-lo como uma grande esfera de K+ atraído pelo íon de geometria linear de OCl-.
Pode-se pensar que, ao contrário do NaOCl, o KOCl forma cristais com energia de rede mais baixa, porque K+ é maior que Na+ em comparação com OCl-. Essa maior dissimilaridade entre seus raios iônicos torna as forças eletrostáticas presentes entre eles menos eficazes..
Além disso, pode-se esperar que o desempenho em solução aquosa para este sal seja semelhante ao do NaOCl. Cercado por água, o K+ -mais volumoso - deve ter uma esfera de hidratação maior que a do Na+. Caso contrário, as propriedades de suas soluções (cor, odor e poder de branqueamento) não diferem em um grau significativo..
Nomenclatura
Por que o sal de hipoclorito de potássio é assim chamado? Para responder, deve-se recorrer à nomenclatura de sais ternários regida pela IUPAC. Em primeiro lugar, porque o potássio só tem valência +1, não é necessário anotá-lo; portanto, é ignorado. Portanto, não escreva hipoclorito de potássio (I).
O ácido clórico tem a fórmula HClO3. À medida que o número de oxigênios diminui, o átomo de cloro ganha mais elétrons; ou seja, tem menos números de oxidação positivos. Por exemplo, neste ácido, o Cl tem um número de oxidação de +5.
Como em HClO, Cl tem um número de oxidação de +1 que, além disso, tem duas unidades a menos de átomos de O (1 em vez de 3 em comparação com HClO3), seu sufixo de nome muda para -oso. Da mesma forma, como +1 é o menor número de oxidação que o átomo de Cl pode atingir, o prefixo -hypo é adicionado..
Portanto, o HClO é chamado de ácido hipocloroso. No entanto, KOCl é seu sal de potássio e para números de oxidação de Cl menores que +5, o sufixo -oso é trocado pelo sufixo -ito. Caso contrário, para números de oxidação iguais ou maiores que +5, o sufixo é alterado para -ate. Então, o nome continua hipoclorito de potássio.
Propriedades
Massa molar
90,55 g / mol.
Aparência
É um líquido ligeiramente acinzentado.
Densidade
1,16 g / cm3
Ponto de fusão
-2 ° C (28 ° F; 271 ° K). Este baixo ponto de fusão, apesar do caráter iônico de suas ligações, demonstra a fraca energia da rede cristalina de seu sólido puro, um produto das cargas monovalentes de K+ e o OCl-, e ao contrário de seus raios iônicos.
Ponto de ebulição
102 ° C (216 ° F; 375 ° K). É apenas um pouco mais alto que a água pura.
Solubilidade em água
25% p / v, sendo este um valor razoável dada a facilidade das moléculas de água em solvatar os íons K+.
As soluções aquosas de hipoclorito de potássio têm qualidades de branqueamento, assim como as de NaOCl. É irritante e pode causar graves danos em contato com a pele, olhos e membranas mucosas. Da mesma forma, sua inalação produz irritação brônquica, dificuldade respiratória e edema pulmonar..
Reatividade
-O hipoclorito de potássio é um poderoso agente oxidante que não é considerado um elemento causador de incêndios ou explosões. No entanto, é capaz de se combinar com diferentes elementos químicos para produzir compostos inflamáveis e explosivos..
-Em contato com a uréia pode formar NCl3, um composto altamente explosivo. Quando aquecido ou colocado em contato com ácidos, produz fumaça de cloreto altamente tóxica. Reage vigorosamente com carvão em uma reação potencialmente explosiva.
-Ele se combina com o acetileno para formar o cloroacetileno explosivo. Da mesma forma, sua reação com matéria orgânica, óleo, hidrocarbonetos e álcoois pode causar explosões. Sua reação com nitrometano, metanol e etanol pode se tornar explosiva.
-Ele se decompõe liberando oxigênio, processo que pode ser catalisado pela ferrugem ou pelo recipiente metálico que o contém..
-O hipoclorito de potássio deve ser armazenado resfriado para evitar a formação de clorato de potássio, cuja decomposição pode até ser explosiva..
Formulários
-Usado como desinfetante de superfície e água potável.
-A degradação em solos do hipoclorito de potássio em cloreto de potássio tem sugerido seu uso em lavouras como fonte de potássio, um elemento nutricional primário para as plantas..
-Algumas empresas têm sugerido sua aplicação como substituto do NaOCl como agente clareador, alegando as propriedades benéficas do íon K+ contra o impacto ambiental causado pelo Na+.
Referências
- Enviro Tech. A solução sem sódio. [PDF]. Obtido em 29 de maio de 2018, em: envirotech.com
- PubChem. (2018). Hipoclorito de potássio. Obtido em 29 de maio de 2018, em: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Hipoclorito de potássio. Obtido em 29 de maio de 2018, em: en.wikipedia.org
- Livro Químico. (2017). Hipoclorito de potássio. Obtido em 29 de maio de 2018, em: chemicalbook.com
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 873, 874.

Ainda sem comentários