
Estrutura, propriedades, usos, riscos do hidróxido de mercúrio

O hidróxido de mercúrio É um composto inorgânico no qual o mercúrio metálico (Hg) tem um número de oxidação de 2+. Sua fórmula química é Hg (OH)dois. No entanto, esta espécie ainda não foi obtida na forma sólida em condições normais..
O hidróxido de mercúrio ou hidróxido de mercúrio é um intermediário transitório de vida curta na formação de óxido de mercúrio HgO em solução alcalina. A partir de estudos realizados em soluções de óxido mercúrico HgO, deduziu-se que Hg (OH)dois é uma base fraca. Outras espécies que o acompanham são HgOH+ e o Hgdois+.

Apesar de não ser capaz de precipitar em solução aquosa, Hg (OH)dois Foi obtido pela reação fotoquímica do mercúrio com o hidrogênio e o oxigênio a temperaturas muito baixas. Também foi obtido na forma de um coprecipitado juntamente com Fe (OH)3, onde a presença de íons haleto influencia o pH em que ocorre a co-precipitação.
Uma vez que não foi facilmente obtido puro em nível de laboratório, não foi possível encontrar qualquer uso para este composto, nem determinar os riscos de seu uso. No entanto, pode-se deduzir que apresenta os mesmos riscos que os demais compostos de mercúrio.
Índice do artigo
- 1 Estrutura da molécula
- 2 configuração eletrônica
- 3 Nomenclatura
- 4 propriedades
- 4.1 Peso molecular
- 4.2 Propriedades químicas
- 5 Obtendo
- 5.1 Hidróxido de mercúrio puro
- 5.2 Co-precipitação com hidróxido de ferro (III)
- 6 usos
- 7 estudos recentes
- 8 riscos
- 9 referências
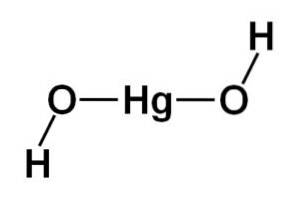
Estrutura da molécula
A estrutura do hidróxido de mercúrio (II) Hg (OH)dois é baseado em uma porção central linear formada pelo átomo de mercúrio com os dois átomos de oxigênio nas laterais.
Os átomos de hidrogênio estão ligados a essa estrutura central, cada um próximo a cada oxigênio, que gira livremente em torno de cada oxigênio. Pode ser representado de forma simples da seguinte forma:
Configuração eletronica
A estrutura eletrônica do mercúrio metálico Hg é a seguinte:
[Xe] 5d10 6sdois
onde [Xe] é a configuração eletrônica do gás nobre xenônio.
Ao observar esta estrutura eletrônica, deduz-se que o estado de oxidação mais estável do mercúrio é aquele em que os 2 elétrons da camada 6 são perdidos.s.
Em hidróxido mercúrico Hg (OH)dois, o átomo de mercúrio (Hg) está em seu estado de oxidação 2+. Portanto, no Hg (OH)dois O mercúrio tem a seguinte configuração eletrônica:
[Xe] 5d10
Nomenclatura
- Hidróxido de mercúrio (II)
- Hidróxido mercúrico
- Dihidróxido de mercúrio
Propriedades
Peso molecular
236,62 g / mol
Propriedades quimicas
De acordo com as informações consultadas, é possível que Hg (OH)dois ser um composto transitório na formação de HgO em meio aquoso alcalino.
A adição de íons hidroxila (OH-) a uma solução aquosa de íons mercúricos Hgdois+ leva à precipitação de um sólido amarelo de óxido de mercúrio (II) HgO, do qual Hg (OH)dois é um agente temporário ou temporário.

Em solução aquosa Hg (OH)dois É um intermediário de vida muito curta, pois libera rapidamente uma molécula de água e precipita HgO sólido.
Embora não tenha sido possível precipitar o hidróxido de mercúrio Hg (OH)dois, O óxido de mercúrio (II) HgO é um tanto solúvel em água, formando uma solução de espécies denominadas “hidróxidos”.
Essas espécies na água chamadas “hidróxidos” são bases fracas e, embora às vezes se comportem como anfotéricas, em geral Hg (OH)dois é mais básico do que ácido.
Quando HgO se dissolve em HClO4 estudos indicam a presença de íon mercúrico Hgdois+, um íon mono-hidroximercúrico HgOH+ e hidróxido mercúrico Hg (OH)dois.
Os equilíbrios que ocorrem em tais soluções aquosas são os seguintes:
Hgdois+ + HdoisO ⇔ HgOH+ + H+
HgOH+ + HdoisO ⇔ Hg (OH)dois + H+
Em soluções alcalinas de NaOH a espécie Hg (OH) é formada3-.
Obtendo
Hidróxido de mercúrio puro
Hidróxido de mercúrio (II) Hg (OH)dois Não pode ser obtido em solução aquosa, porque ao adicionar álcali a uma solução de íons mercúricos Hgdois+, Precipitados de HgO de óxido mercúrico amarelo.
No entanto, alguns pesquisadores conseguiram obter o hidróxido de mercúrio Hg (OH) pela primeira vez em 2005dois usando uma lâmpada de arco de mercúrio, partindo do elemento mercúrio Hg, hidrogênio Hdois e oxigênio Odois.

A reação é fotoquímica e foi realizada na presença de néon sólido, argônio ou deutério a temperaturas muito baixas (cerca de 5 K = 5 graus Kelvin). A evidência da formação do composto foi obtida por espectros de absorção de luz IV (infravermelho).
Hg (OH)dois preparado desta forma é muito estável nas condições de experiência. Estima-se que a reação fotoquímica prossegue através do intermediário O-Hg-O até a molécula estável H-O-Hg-O-H.
Coprecipitação com hidróxido de ferro (III)
Se o sulfato de mercúrio (II) HgSO se dissolver4 e sulfato de ferro (III) Fedois(SW4)3 em solução aquosa ácida, e o pH começa a aumentar pela adição de uma solução de hidróxido de sódio NaOH, após um tempo de espera forma-se um sólido que se infere ser um co-precipitado de Hg (OH)dois e Fe (OH)3.
Verificou-se que a formação de Hg (OH)dois é uma etapa crítica nesta co-precipitação com Fe (OH)3.
A formação de Hg (OH)dois no precipitado Fe (OH)3-Hg (OH)dois depende fortemente da presença de íons como flúor, cloreto ou brometo, de sua concentração específica e do pH da solução.
Na presença de flúor (F-), em pH superior a 5, a coprecipitação de Hg (OH)dois com Fe (OH)3 não é afetado. Mas a um pH de 4 a formação de complexos entre Hgdois+ e o F- interfere com a co-precipitação de Hg (OH)dois.
No caso da presença de cloreto (Cl-), a co-precipitação de Hg (OH)dois ocorre a um pH de 7 ou superior, isto é, de preferência em um meio alcalino.
Quando brometo (Br-), a co-precipitação de Hg (OH)dois ocorre em pH ainda mais alto, ou seja, pH acima de 8,5, ou mais alcalino do que com cloreto.
Formulários
A partir da revisão das fontes de informação disponíveis, deduz-se que o hidróxido de mercúrio (II) Hg (OH)dois, Por ser um composto ainda não preparado comercialmente, não tem usos conhecidos.
Estudos recentes
Utilizando técnicas de simulação computacional em 2013, foram estudadas as características estruturais e energéticas relacionadas à hidratação do Hg (OH).dois em estado gasoso.
Coordenação metal-ligante e energias de solvatação foram calculadas e comparadas variando o grau de hidratação de Hg (OH)dois.
Entre outras coisas, foi descoberto que, aparentemente, o estado de oxidação teórico é 1+ em vez do presumido 2+ geralmente atribuído ao Hg (OH)dois.
Riscos
Embora Hg (OH)dois como tal, não foi isolado em quantidade suficiente e, portanto, não foi usado comercialmente, seus riscos específicos não foram determinados, mas pode-se inferir que apresenta os mesmos riscos que o resto dos sais de mercúrio.
Pode ser tóxico para o sistema nervoso, sistema digestivo, pele, olhos, sistema respiratório e rins..
A inalação, ingestão ou contato com a pele de compostos de mercúrio pode causar danos que vão desde irritação nos olhos e na pele, insônia, dores de cabeça, tremores, danos ao trato intestinal, perda de memória, insuficiência renal, entre outros sintomas.
O mercúrio foi reconhecido internacionalmente como poluente. A maioria dos compostos de mercúrio que entram em contato com o meio ambiente são metilados por bactérias presentes nos solos e sedimentos, formando metilmercúrio.
Esse composto se bioacumula nos organismos vivos, passando do solo às plantas e daí aos animais. No meio aquático a transferência é ainda mais rápida, passando de espécies muito pequenas para grandes em um curto espaço de tempo..
O metilmercúrio tem um efeito tóxico para os seres vivos e em particular para os humanos, que o ingerem através da cadeia alimentar.
Quando ingerido com alimentos, é especialmente prejudicial para crianças pequenas e fetos em mulheres grávidas, pois, sendo uma neurotoxina, pode causar danos ao cérebro e ao sistema nervoso em formação e crescimento..
Referências
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Wang, Xuefeng e Andrews, Lester (2005). Espectro infravermelho de Hg (OH)dois em Solid Neon e Argon. Inorganic Chemistry, 2005, 44, 108-113. Recuperado de pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Solvatação Aquosa de Hg (OH)dois: Estudos da Teoria Funcional da Densidade Energética e Dinâmica do Hg (OH)dois-(HdoisOU)n (n = 1-24) Estruturas. J. Phys. Chem. A 2013, 117, 9069-9075. Recuperado de pubs.acs.org.
- Inoue, Yoshikazu e Munemori, Makoto. (1979). Coprecipitação de Mercúrio (II) com Hidróxido de Ferro (III). Ciência e tecnologia ambiental. Volume 13, número 4, abril de 1979. Recuperado de pubs.acs.org.
- Chang, L.W., et al. (2010). Sistema Nervoso e Toxicologia Comportamental. In Comprehensive Toxicology. Recuperado de sciencedirect.com.
- Haney, Alan e Lipsey, Richard L. (1973). Acúmulo e efeitos do hidróxido de metilmercúrio na cadeia alimentar terrestre em condições de laboratório. Environ. Pollut. (5) (1973) pp. 305-316. Recuperado de sciencedirect.com.



Ainda sem comentários