
Fórmula molecular como obtê-lo, exemplos e exercícios
O Fórmula molecular É a representação de uma molécula de um composto, em que os átomos de todos os elementos presentes no composto e seu número são indicados por seus símbolos químicos. Cada átomo é acompanhado por um subscrito.
A fórmula molecular tem a limitação de não indicar as ligações dos diferentes átomos da molécula, nem sua relação espacial; como faz a fórmula estrutural. Em alguns casos, não é específico, por exemplo: C6H12OU6 é a fórmula molecular de glicose, galactose e frutose.
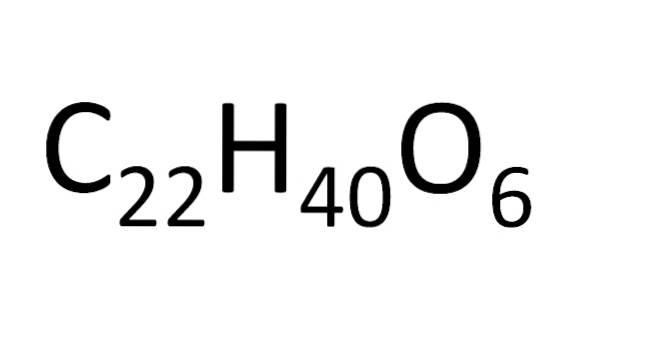
Existe um conjunto de regras para o arranjo dos átomos em uma fórmula molecular. Para sais iônicos, por exemplo, cloreto de sódio, o símbolo do cátion (Na+) e, em seguida, o símbolo do ânion (Cl-) É por isso que a fórmula molecular do cloreto de sódio é NaCl.
A fórmula molecular dos compostos orgânicos é escrita colocando o símbolo do carbono (C) primeiro, seguido pelo símbolo do hidrogênio (H) e, em seguida, os átomos restantes. Por exemplo, a fórmula molecular do ácido acético é CdoisH4OUdois.
Índice do artigo
- 1 Como obter a fórmula molecular
- 1.1 Primeiro passo
- 1.2 Segunda etapa
- 1.3 Terceira etapa
- 1.4 Quarta etapa
- 1.5 Quinto passo
- 2 Exemplos de fórmulas moleculares
- 3 exercícios resolvidos
- 3.1 - Exercício 1
- 3.2 - Exercício 2
- 4 referências
Como obter a fórmula molecular
A obtenção da fórmula molecular de um composto baseia-se no estabelecimento prévio de sua fórmula mínima ou empírica. Por esse motivo, as etapas iniciais para a obtenção de ambas as fórmulas são comuns..
Primeiro passo
É comum expressar a massa dos elementos de um composto químico em forma de porcentagem. Um cálculo simples deve então ser realizado para transformar as porcentagens de massa dos diferentes elementos em suas massas expressas em gramas..
Segundo passo
Conhecendo a massa em gramas de cada um dos elementos, e sua massa atômica, o número relativo de cada átomo ou o número de moles de cada átomo pode ser obtido dividindo a massa de cada um dos diferentes elementos por sua massa atômica..
Terceiro passo
Divida os números relativos de todos os átomos, insira o número relativo do valor menor. Os valores da proporção mínima devem ser números inteiros. No caso de um valor da proporção conter um decimal, uma correção deve ser feita para que esse decimal desapareça.
A correção consiste em multiplicar todos os valores da proporção por um número que retorna inteiros para todos os valores. Por exemplo, se um valor da proporção mínima for 1,25, todos os valores devem ser multiplicados por quatro (4). Como 1,25 vezes 4 é igual a 5, um número inteiro.
Quarto passo
Todos os símbolos químicos dos elementos do composto serão colocados e com seus respectivos subscritos; ou seja, o valor da proporção mínima do elemento.
Quinto passo
A fórmula mínima de um composto pode ser transformada em sua fórmula molecular pela obtenção da razão entre o peso molecular do composto e o peso de sua fórmula mínima (n). Essa relação é a mesma que existe entre a fórmula molecular e a fórmula mínima.
n = peso molecular do composto / peso da fórmula mínima
Para obter a fórmula molecular, a fórmula mínima deve ser multiplicada por n. Isso implica que cada um dos índices da fórmula mínima deve ser multiplicado por n.
n = Peso molecular / Peso mínimo da fórmula
= Fórmula molecular / Fórmula mínima
Fórmula molecular = fórmula mínima
Exemplos de fórmulas moleculares
Algumas fórmulas moleculares comuns estão listadas abaixo:
-Óxido ferroso (FeO)
-Hidróxido de sódio (NaOH)
-Óxido de potássio (KdoisOU)
-Óxido perclórico (CldoisOU7)
-Hidróxido férrico [Fe (OH)3]
-Cloreto de cálcio (CaCldois)
-Ácido clorídrico (HCl)
-Sulfato de sódio (NdoisSW4)
-Ácido sulfúrico (HdoisSW4)
-Ácido perbrômico (HBrO4)
-Cloreto de alumínio (AlCl3)
-Metano (CH4)
-Propano (C3H8)
-Etano (CdoisH6)
-Álcool etílico (CdoisH6OU)
-Ácido acético (CdoisH4OUdois)
-Benzeno (C6H6)
-Glicose (C6H12OU6)
Exercícios resolvidos
- Exercício 1
Benzoato de metila tem as seguintes porcentagens de massa:
C: 70,57%,
H: 5,93%
Ou: 23,49%
E um peso molecular de 136,1 g / mol. Determine a fórmula molecular.
Primeiro passo
O primeiro passo é expressar os percentuais de massa dos elementos em suas massas em gramas, sabendo que os percentuais de massa estão em relação ao peso molecular..
Dos 136,1 gramas correspondentes à mole do composto, 70,57% representa apenas carbono. E assim por diante com os elementos restantes:
Massa de carbono = 136,1 g (70,57 / 100)
= 96,05 g
Massa de hidrogênio = 136,1 g (5,93 / 100)
= 8,06 g
Massa de oxigênio = 136,1 (23,49 / 100)
= 31,96 g
Segundo passo
Na elaboração da fórmula molecular, os números relativos de átomos (NRA) devem ser determinados. Para fazer isso, as massas dos elementos são divididas por suas massas atômicas:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Terceiro passo
Devemos então calcular as proporções mínimas dos elementos (PME). Para fazer isso, todos os valores de NRA são divididos pelo menor valor de NRA:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Quarto passo
Escreva a fórmula mínima para o benzoato de metila, com base no fato de que os subscritos dos elementos são suas proporções mínimas calculadas:
C4H4OU
Quinto passo
Finalmente, a fórmula molecular do benzoato de metila deve ser estabelecida. Portanto, calculamos n:
n = peso molecular / peso mínimo da fórmula
O peso da fórmula mínima é 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Fórmula molecular = 2 fórmula mínima
= 2 C4H4OU
Fórmula molecular de benzoato de metila = C8H8OUdois
- Exercício 2
As porcentagens dos elementos que compõem o benzeno são as seguintes:
C: 92,36%
H: 7,64%.
O peso molecular do benzeno é 78 g / mol. Determine sua fórmula molecular.
Primeiro passo
Transforme as porcentagens de massa dos elementos em suas massas em gramas:
Massa de carbono = 78 g (92,36 / 100)
= 72,04 g
Massa de hidrogênio = 78 g (7,64 / 100)
= 5,96 g
Segundo passo
Cálculo do número relativo de átomos (NRA). Para fazer isso, as massas dos elementos são divididas por suas massas atômicas:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Terceiro passo
Cálculo dos valores da proporção mínima dos elementos (PME). Isso é calculado dividindo os valores de NRA de todos os itens pelo menor valor de NRA:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Quarto passo
Escrita da fórmula mínima para o benzeno, levando em consideração que os subscritos dos elementos são os valores da proporção mínima calculada.
Fórmula mínima de benzeno: CH
Quinto passo
Estabelecimento da fórmula molecular calculando a relação entre a massa molecular e a massa da fórmula mínima:
n = Peso molecular / Peso da fórmula mínima
= 78 g / 13 g
n = 6
Fórmula molecular = fórmula mínima
= 6CH
= C6H6
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Wikipedia. (2020). Fórmula química. Recuperado de: en.wikipedia.org
- Aprendizagem sem limites. (s.f.). Fórmulas moleculares. Recuperado de :ourses.lumenlearning.com
- Helmenstine, Anne Marie, Ph.D. (29 de setembro de 2019). Calcule fórmulas empíricas e moleculares. Recuperado de: Thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Como usar fórmulas empíricas para encontrar fórmulas moleculares. Recuperado de: dummies.com



Ainda sem comentários