
Propriedades, riscos e usos do ferrocianeto de potássio
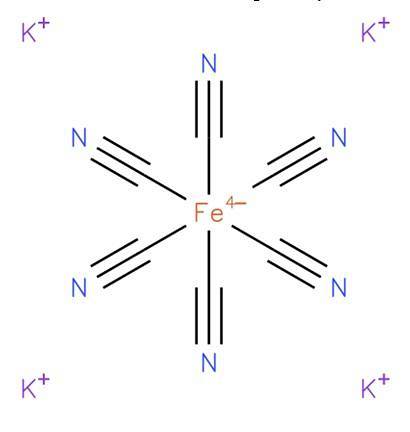
O ferrocianeto de potássio, também conhecido como hexacianoferrato de potássio (II) ou amarelo da Prússia, é um composto inorgânico de fórmula K4[Faith (CN)6] É um sal de potássio do complexo de coordenação de ferrocianeto (Fe (CN)64-) e está geralmente na forma tri-hidratada K4[Faith (CN)6] · HdoisO. Sua estrutura é mostrada na figura 1 (EMBL-EBI, 2008).
Historicamente, era feito de fontes de dióxido de carbono de origem orgânica, limalha de ferro e carbonato de potássio. Fontes comuns de nitrogênio e carbono foram sucata de couro, vísceras ou sangue seco.
Atualmente o ferrocianeto de potássio é produzido industrialmente a partir de cianeto de hidrogênio, cloreto ferroso e hidróxido de cálcio, cuja combinação dá Cadois [Faith (CN) 6] · 11HdoisOU.
Esta solução é então tratada com sais de potássio para precipitar o sal CaK de cálcio e potássio misturado.dois [Faith (CN) 6], que por sua vez é tratado com carbonato de potássio para dar o sal tetrapotássico.
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 2.1 Contato visual
- 2.2 Contato com a pele
- 2.3 Inalação
- 2.4 Ingestão
- 3 usos
- 3.1 1- Indústria Alimentar
- 3.2 2- Indústria de mineração e metalurgia
- 3.3 3- Reagente de laboratório
- 4 referências
Propriedades físicas e químicas
O ferrocianeto de potássio é um cristal monoclínico de cor amarela ou amarelo pálido, dependendo do nível de hidratação, sem aroma característico (National Center for Biotechnology Information., 2017). Sua aparência é mostrada na figura 2 (ferrocianeto de potássio, 2017).

O composto tem um peso molecular de 368,35 g / mol para a forma anidra e 422,388 g / mol para a forma tri-hidratada. Tem uma densidade de 1,85 g / ml e um ponto de fusão de 70 ° C onde começa a se decompor (Royal Society of Chemistry, 2015).
O composto é solúvel em água, podendo dissolver 28,9 gramas do composto em 100 ml deste solvente. É insolúvel em éter dietílico, etanol e tolueno. O composto reage ao calor para formar cianeto de potássio de acordo com a reação:
K4[Faith (CN)6] → 4 KCN + FeCdois + Ndois
Em combinação com ácidos concentrados, forma cianeto de hidrogênio (HCN), que é um gás altamente venenoso, inflamável e pode formar misturas explosivas no ar (Laffort, 2001)..
Reatividade e perigos
O ferrocianeto de potássio é um composto estável, incompatível com ácidos fortes e agentes oxidantes. O ferrocianeto de potássio não é tóxico e não se decompõe em cianeto no corpo. A toxicidade em ratos é baixa, com uma dose letal (LD50) de 6400 mg / kg.
A substância é tóxica para os pulmões e as membranas mucosas. O composto pode causar irritação em caso de contato com a pele e os olhos..
Quando ingerido pode causar irritação do trato gastrointestinal e em caso de inalação causa irritação da mucosa nasal e do sistema respiratório..
O contato com os olhos pode resultar em danos à córnea ou cegueira. O contato com a pele pode causar inflamação e bolhas.
A inalação de poeira produzirá irritação do trato gastrointestinal ou respiratório, caracterizada por ardor, espirros e tosse. A superexposição severa pode causar danos aos pulmões, sufocação, perda de consciência ou morte..
Contato visual
Em caso de contato com os olhos, as lentes de contato devem ser verificadas e removidas. Os olhos devem ser lavados imediatamente com bastante água fria por pelo menos 15 minutos.
Contato com a pele
A área afetada deve ser enxaguada imediatamente com bastante água por pelo menos 15 minutos enquanto se remove roupas e sapatos contaminados. Cubra a pele irritada com um emoliente.
Lave roupas e sapatos antes de reutilizá-los. Se o contato for severo, lave com sabonete desinfetante e cubra a pele contaminada com um creme antibacteriano.
Inalação
A vítima deve ser removida para um local fresco. Se não estiver respirando, deve-se administrar respiração artificial. Se a respiração estiver difícil, dê oxigênio.
Ingestão
Se o composto for ingerido, o vômito não deve ser induzido, a menos que seja orientado por um médico. Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata.
Em todos os casos, atenção médica deve ser obtida imediatamente (Folha de Dados de Segurança de Material Ferrocianeto de potássio tri-hidratado, 2013).
Formulários
1- Indústria Alimentar
O amarelo da Prússia também é conhecido por seu número de aditivo alimentar europeu aprovado: E536 e tem vários usos na indústria de alimentos. É usado como um agente antiaglomerante para sal rodoviário e sal de mesa.
Tem também uma utilização enológica na remoção do cobre e do ferro na vinificação. O cobre é usado como fungicida em uvas (Wageningen University, 2014).
Também é usado para a fermentação de ácido cítrico (D. S. Clark, 1965). O ferrocianeto de potássio também pode ser usado como fertilizante para plantas.
2- Indústria de mineração e metalurgia
O ferrocianeto de potássio é usado para remover o cobre dos minerais de molibdênio. Também é usado para a cimentação de aço (ferrocianeto de potássio, K4Fe (CN) 6, 2012).
A cimentação é um tratamento termoquímico aplicado a peças de aço. O processo traz carbono à superfície por difusão, que é impregnado pela modificação de sua composição.
3- Reagente de laboratório
O ferrocianeto de potássio é usado para determinar a concentração de permanganato de potássio, um composto frequentemente usado em titulações baseadas em reações redox..
O ferrocianeto de potássio é usado em uma mistura com ferricianeto de potássio e solução tamponada com fosfato para fornecer um tampão para beta-galactosidase, que é usado para clivar X-Gal (5-bromo-4-cloro-3-indolil-β-D-galactopiranosídeo, dando uma visualização em azul brilhante onde um anticorpo (ou outra molécula), conjugado com Beta-gal, se ligou ao seu alvo.
O composto também é usado para a produção de azul da Prússia. Ao reagir com o Fe (III), apresenta uma cor azul da Prússia, razão pela qual é usado como reagente de identificação do ferro em laboratórios..
Também é usado para a determinação de zinco em amostras de sulfeto de zinco. A amostra é dissolvida em HCl 6N e ferva sob um capuz para remover o sulfeto de hidrogênio, neutralize com hidróxido de amônio e adicione 3 gotas de HCl.
Aqueça até ferver e adicione 5ml da solução 1N de ferrocianeto de potássio. A presença de um precipitado de ferrocianeto de zinco branco indica um teste positivo para este elemento (Mehlig, 1927).
Referências
- S. Clark, K. I. (1965). Efeito do ferrocianeto de potássio na composição química do melaço de melaço usado na fermentação do ácido cítrico. Biotecnologia e bioengenharia Volume 7, Edição 2, 269-278. Recuperado de onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 de janeiro). hexacianoferrato de potássio (4−). Recuperado de ebi.ac.uk.
- (2001, 5 de março). FERROCIANURA DE POTÁSSIO. Recuperado de laffort.com.
- Folha de Dados de Segurança de Material Ferrocianeto de potássio tri-hidratado. (2013, 21 de maio). Recuperado de sciencelab.com.
- Mehlig, J. P. (1927). Uso de ferrocianeto de potássio como teste confirmatório para zinco. Chem. Educ. 4 (6), 722. Recuperado de pubs.acs.org.
- National Center for Biotechnology Information ... (2017, 15 de abril). PubChem Compound Database; CID = 161067. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Ferrocianeto de potássio. (25 de março de 2017). Recuperado de sciencemadness.org.
- Ferrocianeto de potássio, K4Fe (CN) 6. (2012). Recuperado de atomistry.com.
- Royal Society of Chemistry. (2015). ferrocianeto de potássio. Recuperado de chemspider.com.
- Wageningen University. (2014, 14 de agosto). E536: Ferrocianeto de potássio. Recuperado de food-info.net.



Ainda sem comentários