
Exame de fezes, amostragem, técnicas, exemplos
O exame de fezes é um estudo de laboratório no qual a matéria fecal (fezes) é examinada para detectar parasitas intestinais. É uma das técnicas de laboratório mais simples e antigas, sendo inicialmente desenvolvida por Anton Van Leeuwenhoek no século XVIII..
Anton Van Leeuwenhoek, considerado o pai da microbiologia, usou o método coproparasítico-toscópico “direto” para observar suas próprias fezes e descreveu o que anos depois foram identificados como trofozoítos de Giardia lamblia, um protozoário que invade o intestino delgado do homem.
As doenças parasitárias afetam milhões de pessoas no mundo, principalmente em países pobres ou subdesenvolvidos, onde há precárias condições sanitárias relacionadas ao descarte de excrementos e ao consumo de água contaminada..
O diagnóstico dessas doenças é importante para um tratamento adequado, sendo o exame coproparasitoscópico uma ferramenta indispensável para isso. É um teste de laboratório simples, rápido e barato.
O exame de fezes inclui várias técnicas que, além de permitir a visualização e quantificação direta de ovos, trofozoítos, cistos ou larvas, permitem identificar as estruturas do microrganismo e, assim, identificar o parasita..
As técnicas usadas para exame de fezes incluem técnicas de coloração com azul de metileno, métodos de concentração, a técnica de Faust, Richie, técnicas de sedimentação e exames diretos, únicos ou seriados..
Índice do artigo
- 1 coleta de amostra
- 2 técnicas
- 2.1 Exames diretos
- 2.2 Técnicas de suspensão e concentração
- 3 exemplos
- 4 referências
Amostragem
Para realizar este estudo, o paciente deve coletar uma amostra de fezes frescas que não estejam contaminadas com urina, água, sangue (menstrual) ou sujeira. A amostra deve ser do tamanho de uma noz ou, se for líquida, deve ter pelo menos o volume correspondente a duas colheres de sopa.
O paciente não deve ter tomado medicamentos parasiticidas por pelo menos três dias antes da coleta da amostra ou pelo período indicado pelo médico. Você também não deve usar medicamentos laxantes.
As amostras devem ser colocadas em um recipiente seco, de boca larga, com tampa ou um recipiente descartável especialmente projetado (disponível na farmácia de sua preferência). As amostras devem ser colocadas em um ambiente fresco, não devem ser refrigeradas por mais de 24 horas e não devem ser armazenadas perto de fontes de calor ou congeladas.
Quando o exame indicado é seriado, são necessárias pelo menos três coletas, que devem ser colhidas a cada 24 horas ou mais, conforme indicação do médico. Para esses casos, os laboratórios geralmente fornecem um conjunto de frascos contendo soluções com conservantes..
Quando o paciente observar um "verme" nas fezes, se possível, ele deve colocá-lo em um frasco fechado com água e levá-lo ao laboratório junto com o frasco da amostra de fezes..
Os frascos com as amostras ou com os “vermes” devem ser rotulados e identificados com o nome do paciente, sua idade, sexo e a data e hora da coleta da amostra..
É muito importante orientar adequadamente o paciente sobre todos esses aspectos da coleta e do manuseio das amostras, pois depende da viabilidade dos elementos que possam existir na referida amostra para observação, identificação e diagnóstico..
Técnicas
Existem testes diretos de fezes e técnicas de suspensão e concentração de amostras que são usadas muitas vezes para evitar falsos negativos e observar amostras muito mais limpas. Algumas técnicas de coloração também são usadas para identificar certos parasitas..
Exames diretos
O exame direto de fezes, pela técnica de brinco de gota, consiste em fazer uma diluição da amostra de fezes com solução fisiológica (NaCl 0,9%) e colocar uma gota desta solução em uma concavidade que possui uma lâmina especial utilizada para este fim..
Uma vez que a gota é colocada na lâmina, ela é coberta com uma lamela e observada ao microscópio. Esta técnica permite observar ovos e cistos, mas também permite observar qualquer elemento móvel como flagelados, larvas, trofozoítos, ciliados, etc..
Técnicas de suspensão e concentração
As técnicas de suspensão utilizam uma solução mais densa que os elementos a serem observados, de forma que estes flutuam na superfície do líquido e possam ser coletados, uma vez que permanecem concentrados na camada superficial da solução..
Esta técnica tem a vantagem de permitir uma amostra bastante limpa dos detritos, uma vez que estes, sendo mais densos, permanecem no fundo da garrafa. A desvantagem relativa é que a solução encolhe e deforma os microrganismos em um curto espaço de tempo.
Esses métodos não são usados para ovos de helmintos e cestódeos porque são muito pesados e não flutuam nessas soluções. Eles são amplamente utilizados para observar protozoários em sua forma tropozóica ou seus ovos e para a observação de larvas como as de. Strongyloides stercoralis.
Outra técnica amplamente utilizada por não deformar os microrganismos da amostra e ser simples e de baixo custo é a técnica de sedimentação com formalina..
Dentre as técnicas de concentração podemos citar como exemplo as técnicas de Faust e Richie..
As diferentes técnicas que permitem a visualização microscópica dos ovos, larvas ou outros elementos dos diferentes parasitas intestinais, aliadas às técnicas de coloração, permitem a identificação e diagnóstico destas doenças..
Exemplos
A seguir, é descrito um caso clínico e mostradas algumas imagens que ilustram a utilidade do exame de fezes para o diagnóstico e avaliação dos benefícios do tratamento..
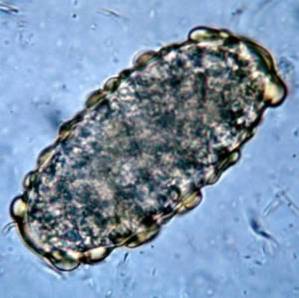
Paciente do sexo masculino, 18 anos, chega ao consultório médico com cólicas abdominais, mais intensas na região periumbilical, náuseas e episódios de diarreia aquosa.
Ao questionar o paciente, o médico observa dois pontos salientes: 1) o paciente refere-se a ter se banhado em um lago da zona rural e 2) fica impressionado com o fato de suas fezes flutuarem no vaso sanitário. Após examinar o paciente, o médico suspeita da presença de Giardia lamblia.
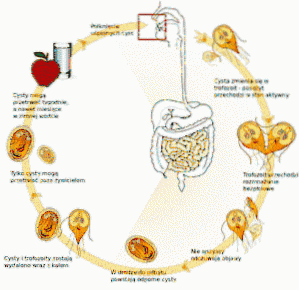
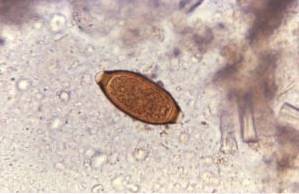
Esse protozoário vive no intestino delgado do homem e interfere na absorção das gorduras, o que gera fezes muito gordurosas que tendem a flutuar. A poluição ocorre frequentemente por causa da água poluída em lagos ou riachos em áreas rurais ou em piscinas ou banheiras de hidromassagem com manutenção deficiente.
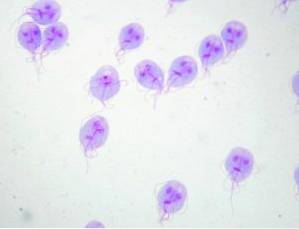
O médico indica um exame de fezes e os resultados confirmam a presença de Giardia lamblia. Após o término do tratamento, outro exame de fezes é indicado, confirmando a ausência de cistos ou trofozoítos de Giardia lamblia.
Referências
- Buonfrate, D., Mena, M. A., Angheben, A., Requena-Mendez, A., Muñoz, J., Gobbi, F.,… & COHEMI Project Study Group. (2015). Prevalência de estrongiloidíase na América Latina: uma revisão sistemática da literatura. Epidemiologia e Infecção, 143(3), 452-460.
- de Haro Arteaga, I., & Ruiz, A. E. C. (2014). Diagnóstico de. Parasitologia médica (4ª, 347.
- Mendoza, D., Nunez, F. A., Escobedo, A. A., Pelayo, L., Fernandez, M., Torres, D., & Cordovi, R. A. (2003). Utilidade de 2 métodos coproparasitológicos e sua utilização em um ensaio terapêutico de antigiardíase. Jornal cubano de medicina tropical, 55(3), 174-178.
- Preço, -D. L. (2017). Manual de procedimento para o diagnóstico de parasitas intestinais. CRC Press.
- Sahin, I., Kiliç, H., Ozca, M., & Orhan, R. (1984). Um estudo copro-parasitológico nos lutadores da seleção nacional. Mikrobiyoloji bülteni, 18(2), 114-118.



Ainda sem comentários