
Características de estado sólido, propriedades, tipos, exemplos

O Estado sólido é uma das principais maneiras pelas quais a matéria é adicionada para criar corpos sólidos ou condensados. A crosta terrestre inteira, deixando de fora os mares e oceanos, é um conglomerado heterogêneo de sólidos. Exemplos de objetos em estado sólido são um livro, uma pedra ou grãos de areia.
Podemos interagir com os sólidos graças à repulsão de nossos elétrons com os de seus átomos ou moléculas. Ao contrário dos líquidos e gases, desde que não sejam severamente tóxicos, nossas mãos não podem passar por eles, mas desintegrá-los ou absorvê-los.

Os sólidos são geralmente muito mais fáceis de manusear ou armazenar do que um líquido ou gás. A menos que suas partículas sejam finamente divididas, uma corrente de vento não o levará em outras direções; são fixados no espaço definido pelas interações intermoleculares de seus átomos, íons ou moléculas.
Índice do artigo
- 1 Conceito de sólido
- 2 Características gerais de sólidos
- 3 propriedades
- 3.1 Pontos de fusão
- 3.2 Estequiometria
- 3.3 Defeitos
- 3.4 Reatividade
- 3.5 Físico
- 4 tipos e exemplos
- 4.1 Sólidos cristalinos
- 4.2 Sólidos amorfos
- 4.3 Iônico
- 4.4 Metálico
- 4.5 Atômico
- 4.6 Molecular e polimérico
- 4.7 Redes covalentes
- 5 referências
Conceito sólido
O sólido é um estado da matéria no qual existe um volume e uma forma rígidos; as partículas que formam materiais ou objetos em estado sólido são fixadas em um só lugar, não são facilmente compressíveis.
Este estado da matéria é o mais variado e rico em termos de química e física. Temos sólidos iônicos, metálicos, atômicos, moleculares e covalentes, cada um com sua unidade estrutural; ou seja, com seus próprios cristais. Quando seu modo de agregação não permite que eles estabeleçam estruturas internas ordenadas, eles se tornam amorfos e intrincados.
O estudo do estado sólido converge na concepção e síntese de novos materiais. Por exemplo, a madeira, um sólido natural, também tem sido usada como material ornamental e para a construção de casas..
Outros materiais sólidos permitem a fabricação de automóveis, aviões, navios, espaçonaves, reatores nucleares, artigos esportivos, baterias, catalisadores e muitos outros objetos ou produtos..
Características gerais de sólidos

As principais características dos sólidos são:
-Eles têm massa, volume e formas definidas. Um gás, por exemplo, não tem fim nem começo, pois dependem do recipiente que o armazena..
-Eles são muito densos. Os sólidos tendem a ser mais densos do que os líquidos e gases; embora haja algumas exceções à regra, especialmente ao comparar líquidos e sólidos.
-As distâncias que separam suas partículas são curtas. Isso significa que eles foram muito coesos ou compactados em seus respectivos volumes.

-Suas interações intermoleculares são muito fortes, caso contrário, não existiriam como tais e se derreteriam ou sublimariam em condições terrestres..

-A mobilidade dos sólidos é geralmente bastante limitada, não só do ponto de vista material, mas também do ponto de vista molecular. Suas partículas estão confinadas em uma posição fixa, onde podem apenas vibrar, mas não se mover ou girar (em teoria).
Propriedades
Pontos de fusão
Todos os sólidos, a menos que se decomponham no processo, e independentemente de serem ou não bons condutores de calor, podem passar para o estado líquido a uma determinada temperatura: seu ponto de fusão. Quando essa temperatura é atingida, suas partículas finalmente conseguem fluir e escapar de suas posições fixas..
Este ponto de fusão dependerá da natureza do sólido, de suas interações, da massa molar e da energia da rede cristalina. Como regra geral, sólidos iônicos e redes covalentes (como diamante e dióxido de silício) tendem a ter os pontos de fusão mais altos; enquanto sólidos moleculares, o mais baixo.
A imagem a seguir mostra como um cubo de gelo (estado sólido) se transforma em um estado líquido:

Estequiometria
Muitos dos sólidos são moleculares, pois são compostos cujas interações intermoleculares permitem que se aglutinem dessa forma. No entanto, muitos outros são iônicos ou parcialmente iônicos, então suas unidades não são moléculas, mas células: um conjunto de átomos ou íons dispostos de maneira ordenada..
É aqui que as fórmulas de tais sólidos devem respeitar a neutralidade das cargas, indicando sua composição e relações estequiométricas. Por exemplo, o sólido cuja fórmula hipotética é AdoisB4OUdois aponta que tem o mesmo número de átomos A que O (2: 2), embora tenha o dobro do número de átomos B (2: 4).
Observe que os subscritos da fórmula AdoisB4OUdois eles são inteiros, o que mostra que se trata de um sólido estequiométrico. A composição de muitos sólidos é descrita por essas fórmulas. As cargas de A, B e O devem somar igual a zero, porque caso contrário, haveria uma carga positiva ou negativa.
Para os sólidos é especialmente útil saber interpretar suas fórmulas já que, geralmente, as composições de líquidos e gases são mais simples..
Defeitos
As estruturas dos sólidos não são perfeitas; apresentam imperfeições ou defeitos, por mais cristalinos que sejam. Este não é o caso de líquidos ou gases. Não existem regiões de água líquida que possam ser afirmadas de antemão que estão "deslocadas" em relação ao seu entorno..
Tais defeitos são responsáveis por os sólidos serem duros e quebradiços, apresentando propriedades como piroeletricidade e piezoeletricidade, ou deixando de ter composições definidas; ou seja, eles são sólidos não estequiométricos (por exemplo, A0,4B1,3OU0,5).
Reatividade
Os sólidos geralmente são menos reativos do que os líquidos e gases; mas não devido a causas químicas, mas ao fato de que suas estruturas evitam que os reagentes ataquem as partículas em seu interior, reagindo primeiro com aquelas em sua superfície. Portanto, as reações envolvendo sólidos tendem a ser mais lentas; a menos que sejam pulverizados.
Quando um sólido está na forma de pó, suas partículas menores têm uma área ou superfície maior para reagir. É por isso que os sólidos finos são frequentemente rotulados como reagentes potencialmente perigosos, pois podem inflamar rapidamente ou reagir vigorosamente em contato com outras substâncias ou compostos..
Os sólidos são freqüentemente dissolvidos em um meio de reação para homogeneizar o sistema e realizar uma síntese com maior rendimento..
Fisica
Com exceção do ponto de fusão e dos defeitos, o que foi dito até agora corresponde mais às propriedades químicas dos sólidos do que às suas propriedades físicas. A física dos materiais está profundamente focada em como a luz, o som, os elétrons e o calor interagem com os sólidos, sejam eles cristalinos, amorfos, moleculares, etc..
É aqui que entra o que é conhecido como sólidos plásticos, elásticos, rígidos, opacos, transparentes, supercondutores, fotoelétricos, microporosos, ferromagnéticos, isolantes ou semicondutores..
Em química, por exemplo, interessam materiais que não absorvem radiação ultravioleta ou luz visível, pois são usados para fazer células de medição para espectrofotômetros de UV-Vis. O mesmo acontece com a radiação infravermelha, quando se deseja caracterizar um composto por meio da obtenção de seu espectro de infravermelho, ou estudar o andamento de uma reação.
O estudo e manipulação de todas as propriedades físicas dos sólidos requerem enorme dedicação, bem como a sua síntese e desenho, escolhendo "peças" de construção inorgânica, biológica, orgânica ou organometálica para novos materiais..
Tipos e exemplos
Como existem vários tipos de sólidos quimicamente, exemplos representativos serão mencionados separadamente para cada um..
Sólidos cristalinos
Por um lado, existem sólidos cristalinos. Esses elementos são caracterizados porque as moléculas que os constituem são configuradas da mesma forma, o que se repete como um padrão em todo o cristal. Cada padrão é chamado de célula unitária.
Os sólidos cristalinos também são caracterizados por terem um ponto de fusão definido; Isso significa que, dada a uniformidade do arranjo de suas moléculas, existe a mesma distância entre cada célula unitária, o que permite que toda a estrutura se transforme constantemente sob a mesma temperatura..
Exemplos de sólidos cristalinos podem ser sal e açúcar..
Sólidos amorfos
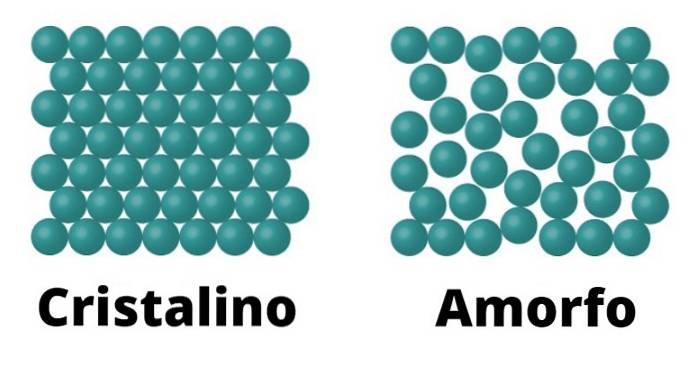
Sólidos amorfos são caracterizados porque a conformação de suas moléculas não responde a um padrão, mas varia ao longo de toda a superfície.
Como não existe tal padrão, o ponto de fusão dos sólidos amorfos não é definido, ao contrário dos cristalinos, o que significa que ele derrete gradualmente e sob diferentes temperaturas..
Exemplos de sólidos amorfos podem ser vidro e a maioria dos plásticos.
Ionics
Os sólidos iônicos são caracterizados por terem cátions e ânions, que interagem entre si por atração eletrostática (ligação iônica). Quando os íons são pequenos, as estruturas resultantes costumam ser sempre cristalinas (levando em consideração seus defeitos). Entre alguns sólidos iônicos temos:
-NaCl (Na+Cl-), cloreto de sódio
-MgO (Mgdois+OUdois-), óxido de magnésio
-Ladrão3 (ACdois+CO3dois-), carbonato de cálcio
-CURSO4 (Cudois+SW4dois-), sulfato de cobre
-KF (K+F-), Fluoreto de Potássio
-NH4Cl (NH4+Cl-), cloreto de amônio
-ZnS (Zndois+Sdois-), sulfeto de zinco
-Fe (C6H5COO)3, benzoato de ferro
Metálico
Como seu nome indica, eles são sólidos que possuem átomos metálicos interagindo através da ligação metálica:
-Prata
-Ouro
-Pista
-Latão
-Bronze
-Ouro Branco
-Peltre
-Aços
-Duralumínio
Observe que as ligas também contam como sólidos metálicos, evidentemente.
Atômico
Os sólidos metálicos também são atômicos, pois em teoria não há ligações covalentes entre os átomos metálicos (M-M). No entanto, gases nobres contam em essência como espécies atômicas, uma vez que apenas as forças dispersivas de Londres predominam entre eles..
Portanto, embora não sejam sólidos de alta aplicação (e difíceis de obter), os gases nobres cristalizados são exemplos de sólidos atômicos; ou seja: hélio, néon, argônio, criptônio, etc., sólidos.
Molecular e polimérico
As moléculas podem interagir por meio de forças de Van der Walls, onde suas massas moleculares, momentos de dipolo, ligações de hidrogênio, estruturas e geometrias desempenham um papel importante. Quanto mais fortes forem essas interações, maior será a probabilidade de estarem na forma de um sólido.
Por outro lado, o mesmo raciocínio se aplica aos polímeros, que devido às suas altas massas moleculares médias são quase sempre sólidos, e vários deles são amorfos; uma vez que suas unidades poliméricas têm dificuldade em se organizar para criar cristais.
Assim, temos entre alguns sólidos moleculares e poliméricos o seguinte:
-Gelo seco

-Açúcar
-Iodo
-Ácido benzóico
-Acetamida
-Enxofre rômbico
-Ácido palmítico
-Fulerenos
-Partida
-Cafeína
-Naftaleno
-Madeira e papel
-Seda
-Teflon
-Polietileno
-Kevlar
-Baquelite
-Cloreto de polivinila
-Poliestireno
-Polipropileno
-Proteína
-Barra de chocolate
Redes covalentes
Finalmente, temos as redes covalentes entre os sólidos de fusão mais duros e mais elevados. Alguns exemplos são:
-Grafite
-Diamante
-Quartzo
-Carboneto de silício
-Nitreto de boro
-Fosforeto de Alumínio
-Arsenieto de gálio
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Wikipedia. (2019). Química do estado sólido. Recuperado de: en.wikipedia.org
- Elsevier B.V. (2019). Química do estado sólido. ScienceDirect. Recuperado de: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Notas de aula sobre química de estado sólido. Recuperado de: unf.edu
- AskIITians. (2019). Características Gerais do Estado Sólido. Recuperado de: askiitians.com
- David Wood. (2019). Como átomos e moléculas formam sólidos: padrões e cristais. Estudar. Recuperado de: study.com



Ainda sem comentários