
Partes e exemplos de equações químicas

O equação química é uma representação esquemática de algumas das características de uma reação química. Também pode ser dito que a equação química descreve as mudanças experimentadas pelas diferentes substâncias envolvidas em uma reação..
As fórmulas e símbolos das diferentes substâncias participantes são colocados na equação química, indicando claramente o número de átomos de cada elemento presente nos compostos, que aparece como um subscrito e não pode ser alterado equilibrando a equação.
A equação química deve parecer equilibrada, ou seja, o número de átomos dos reagentes e dos produtos deve ser igual. Desta forma, a lei de conservação da matéria é obedecida. É desejável que os números usados para equilibrar as equações sejam números inteiros.
Essas equações não revelam as etapas consecutivas, nem por quais mecanismos os reagentes são transformados em produtos..
Por isso, embora sejam muito úteis para entender para onde vai uma reação química, não nos permitem compreender seus aspectos moleculares ou como é afetada por certas variáveis; tais como pH, viscosidade, tempo de reação, velocidade de agitação, entre outros.
Índice do artigo
- 1 partes de uma equação química
- 1.1 Localização de reagentes e produtos
- 1.2 Balanceamento de equações químicas
- 1.3 Estados físicos dos componentes da equação química
- 1.4 Mudanças no estado físico
- 2 Exemplo de equações químicas
- 2.1 - Fotossíntese
- 2.2 - Respiração celular
- 2.3 - Reações de elementos comuns
- 3 referências
Partes de uma equação química
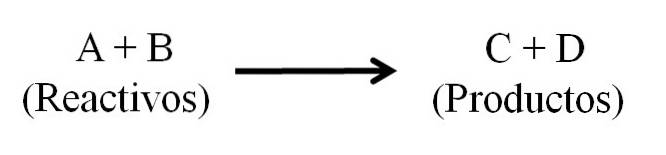
Existem basicamente três partes principais em uma equação química: os reagentes, os produtos e a seta que indica a direção da reação química..
Localização de reagentes e produtos
Todas as substâncias que funcionam como reagentes e todas aquelas que são produtos aparecem na equação química. Esses grupos de substâncias são separados por uma seta que indica a direção da reação. Os reagentes estão localizados à esquerda da seta e os produtos à direita.
A seta significa o que é produzido e é orientada da esquerda para a direita (→), embora nas reações reversíveis existam duas setas equivalentes e paralelas; um direcionado para a direita e outro para a esquerda. O símbolo (Δ) é geralmente colocado acima da seta, indicando que calor foi usado na reação..
Além disso, a identificação do catalisador é geralmente colocada na seta, se possível com sua fórmula ou símbolo. As diferentes substâncias que aparecem como reagentes são separadas pelo sinal (+), indicando que as substâncias reagem ou se combinam entre si.
No caso de substâncias que aparecem como produtos, o sinal (+) não tem a conotação anterior; a menos que a reação seja reversível. É conveniente que o sinal (+) seja colocado equidistante das substâncias que ele separa.
Balanceamento de equações químicas
É um requisito essencial que as equações químicas estejam devidamente balanceadas. Para isso, é colocado um número denominado coeficiente estequiométrico. Sempre que necessário, esse coeficiente deve preceder as substâncias que aparecem como reagentes ou produtos..
Isso ocorre para que o número de todos os átomos dos elementos que aparecem como reagentes seja exatamente igual ao número deles que aparecem no produto. O método mais simples de equilibrar equações químicas é por tentativa e erro..
Estados físicos dos componentes da equação química
Em algumas equações químicas, o estado físico das substâncias é marcado com um subscrito. Para isso, as seguintes abreviaturas são usadas em espanhol: (s) para o estado sólido; (l) para o estado líquido; (g), estado gasoso; e (ac), solução aquosa.
Exemplo: reação de carbonato de cálcio com ácido clorídrico.
Ladrão3 (s) + 2 HCl(ac) → CaCl2 (s) + HdoisOU(eu) + CO2 g)
Mudanças no estado físico
Em alguns casos, é indicado na equação química se há produção de um gás na reação química ou se há precipitação de alguma das substâncias produzidas..
A presença de um gás é indicada por uma seta vertical com sua extremidade apontando para cima (↑), colocada do lado direito da substância gasosa.
Exemplo: reação de zinco com ácido clorídrico.
Zn + 2 HCl → ZnCldois + Hdois↑
Se na reação química uma das substâncias formar um precipitado, isso é simbolizado pela colocação de uma seta vertical com a extremidade voltada para baixo (↓), colocada do lado direito da substância precipitada..
Exemplo: reação de ácido clorídrico com nitrato de prata.
HCl + AgNO3 → HNO3 + AgCl ↓
Exemplo de equações químicas
- Fotossíntese

A fotossíntese é o processo pelo qual as plantas captam e transformam a energia luminosa, proveniente da luz solar, para gerar a energia necessária à sua subsistência. A fotossíntese é realizada por algumas organelas de células vegetais chamadas cloroplastos.
Os tilacóides são encontrados na membrana do cloroplasto, locais onde as clorofilas são encontradas. para Y b, quais são os principais pigmentos que captam a energia da luz.
Embora a fotossíntese seja um processo complexo, ela pode ser delineada na seguinte equação química:
6 COdois + 6 hdoisO → C6H12OU6 + 6 Odois↑ ΔGº = 2.870 kJ / mol
C6H12OU6 É a fórmula da glicose, um carboidrato metabolizado para a produção de ATP; composto que é o principal reservatório de energia na maioria dos seres vivos. Além disso, o NADPH é gerado a partir da glicose, uma coenzima necessária para muitas reações..
- Respiração celular
As células usam oxigênio para o metabolismo de inúmeras substâncias presentes nos alimentos ingeridos. Já o ATP é utilizado como fonte de energia para as atividades dos seres vivos, produzindo gás carbônico e água nesses processos..
Se a glicose for usada como modelo para uma substância metabolizada, a respiração pode ser esquematizada usando a seguinte equação química:
C6H12OU6 + 6 Odois → 6 COdois + 6 hdoisOU
- Reações de elemento comum
Reação de decomposição
Um composto ou compostos se dissociam, formando outros compostos diferentes com seus átomos:
2 KClO3 (s) → 2 KCl(s) + 3 O2 g)
Reação de deslocamento
Um metal reage com um composto, substituindo um metal presente nele:
Mg(s) + CURSO4 (ac) → Cu(s) + MgSO4 (ac)
Reação de eliminação
Neste tipo de reação, o número de átomos ou grupos ligados a um átomo de carbono diminui:
CH3-CHdoisBr + NaOH → HdoisC = CHdois + HdoisO + NaBr
Reação de hidratação
É uma reação em que um composto adiciona uma molécula de água. Esta reação é importante na preparação de álcoois:
HdoisC = CHdois + HdoisO → HdoisC-CHdoisOh
Reação neutralizadora
Uma base ou álcali reage com um ácido produzindo um sal e água:
HCl(ac) + NaOH(ac) → NaCl(ac) + HdoisOU(eu)
Reação de síntese
Nesse tipo de reação, duas ou mais substâncias são combinadas para criar um novo composto:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Reação de duplo deslocamento (metátese)
Nesse tipo de reação há troca de íons positivos e negativos para formar novos compostos:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Irmão mais velho3 (ac)
Referências
- Flores, J. (2002). Química. Edição 1isso foi. Editorial Santillana
- Mathews, C. K., Van Holde, K. E. e Ahern, K. G. (2002). Bioquímica. 3isso foi Edição. Editora Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Wikipedia. (2019). Equação química. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20 de setembro de 2019). O que é uma equação química? Recuperado de: Thoughtco.com



Ainda sem comentários