
Estrutura, propriedades, usos de dodecilsulfato de sódio (SDS)
O dodecilsulfato de sódio (SDS), é um sal orgânico aniônico, sintético e anfifílico. A parte apolar e hidrofóbica corresponde à cadeia de hidrocarbonetos; enquanto a parte polar e hidrofílica se deve ao sulfato, com carga negativa.
O SDS é um surfactante: suas moléculas são colocadas na superfície de soluções aquosas, produzindo uma diminuição na tensão superficial. Esse recurso permite que seja usado em xampus, cremes dentais, sabonetes e outros itens de higiene pessoal e limpeza doméstica..
O dodecil sulfato de sódio se liga à proteína e produz seu desdobramento, adquirindo forma alongada. Os grupos sulfato são expostos à água, adquirindo cargas negativas, cujo número é proporcional ao seu peso molecular..
Por este motivo, o SDS permite a determinação dos pesos moleculares das proteínas por eletroforese de poliacrilamida..
Embora haja suspeita de um possível efeito cancerígeno da SDS, não foi demonstrado de forma conclusiva. O SDS pode causar irritação na pele e nos olhos, como outros detergentes..
Índice do artigo
- 1 Estrutura da SDS
- 1.1 Cristais
- 1,2 micelas
- 2 propriedades
- 2.1 Nomes
- 2.2 Fórmula molecular
- 2,3 massa molar
- 2.4 Descrição física
- 2,5 Odor
- 2.6 Ponto de fusão
- 2.7 Solubilidade em água
- 2.8 Densidade
- 2.9 Estabilidade
- 2.10 Decomposição
- 2.11 Tensão superficial
- 2.12 Concentração molar crítica
- 3 usos
- 3.1 Cuidados pessoais e limpeza em casa
- 3.2 Medicina veterinária e humana
- 3.3 No laboratório
- 3.4 Aditivo alimentar
- 3.5 Indústria
- 4 riscos
- 5 referências
Estrutura da SDS
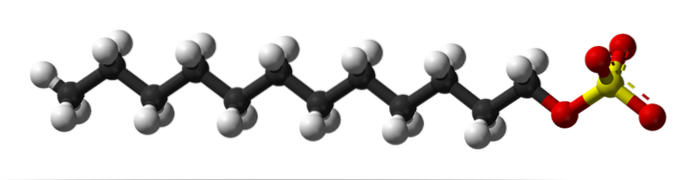
Na primeira imagem, a molécula SDS foi mostrada com um modelo de esferas e hastes. Como pode ser visto, possui cauda carbonatada hidrofóbica e apolar (esferas pretas e brancas); e ao mesmo tempo, uma cabeça polar, graças à presença do grupo -SO4- (esferas amarelas e vermelhas).
Embora não seja mostrado, deve haver uma esfera roxa representando o Na cation+, ao lado do grupo -SO4-, interagindo eletrostaticamente.
Dito isso, é fácil ver por que esse composto é anfifílico; e também um tensoativo aniônico, uma vez que a carga do SDS é negativa e pode atrair outros cátions além do Na+.
A molécula dá a falsa impressão de ser rígida, uma estrutura linear imóvel. No entanto, é exatamente o oposto. O SDS pode ser comparado a um "verme", cuja cauda carbonatada exibe múltiplas vibrações e rotações de suas ligações simples. Isso o torna capaz de adotar diferentes formas ou dobras no meio; na água, por exemplo.
Cristais
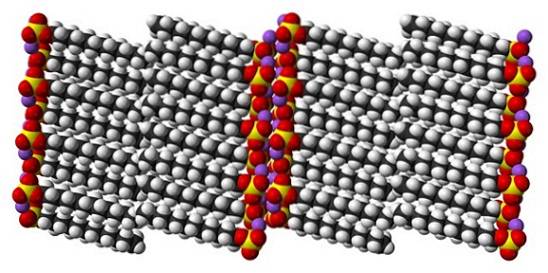
Embora seja verdade que o dodecil sulfato de sódio é uma molécula dinâmica, no estado sólido não precisa se mover muito, comportando-se como um bastão "simples". E assim, cada molécula ou barra é posicionada de forma a aumentar as interações entre as caudas carbonáticas e, ao mesmo tempo, as de suas cargas iônicas..
O resultado é a formação de um cristal monoclínico, onde as moléculas de SDS são empacotadas em várias colunas de barras (imagem superior). As forças intermoleculares que os ligam são tais que esses cristais requerem uma temperatura de 206ºC para derreter na fase líquida..
Micelles
Fora do conforto de seus cristais, a molécula de SDS não pode mais ficar parada; começa a torcer a cauda para aumentar ou diminuir as interações com o ambiente externo.
Se este meio for a água, ocorre um fenômeno denominado formação de micelas: as caudas carbonatadas e hidrofóbicas se unem para se armarem, enquanto as cabeças polares, os grupos -SO4-, permanecem na superfície interagindo com as moléculas de HdoisOU.
A micela então assume uma morfologia elipsóide achatada (como a Terra, mas mais achatada). No vidro, são como blocos de barras e, no meio aquoso, como micelas elipsóides. E se o meio fosse oleoso? A micela seria invertida: as cabeças polares SO4- iria para o núcleo, enquanto suas caudas carbonatadas seriam expostas ao óleo.
Propriedades
Nomes
- Dodecil sulfato de sódio (SDS).
- Lauril Sulfato de Sódio (SLS).
Fórmula molecular
C12H25OU4SNa.
Massa molar
288,378 g / mol.
Descrição física
Várias apresentações: pó seco, líquido ou sólido úmido. Seus cristais são de cor branca ou cremosa.
Odor
Odor fraco de substâncias gordurosas, inodoro.
Ponto de fusão
206 ºC.
Solubilidade em água
1 105 mg / L. 1 g dissolvido em 10 mL de uma solução opalescente.
Densidade
1,01 g / cm3.
Estabilidade
Estável sob as condições de armazenamento recomendadas.
Decomposição
Quando aquecido até a decomposição, emite uma fumaça branca de óxido de enxofre e óxido de sódio.
Tensão superficial
39,5 dinas / cm a 25 ° C.
Concentração molar crítica
É 8,2 mM em água pura a 25 ºC.
Formulários
Cuidados pessoais e limpeza doméstica
O sulfato de dodecila é um surfactante usado em muitos produtos, como sabonetes para as mãos, banhos de espuma, cremes de barbear, etc. Também é usado para remover manchas difíceis de remover de roupas, limpar pisos e banheiros, esfregar itens de cozinha, etc..
Medicina veterinária e humana
É utilizado como repelente de pulgas e carrapatos, presentes em animais. Também é usado como umectante em alguns antibióticos, para uso oral ou tópico..
O SDS é microbicida contra vírus com envelope, como o HIV, tipos 1 e 2, e o vírus herpes simplex (HSV-2). Também atua em vírus não envelopados: papilomavírus, reovírus, rotavírus e poliovírus. No entanto, este uso não é aprovado..
O uso de SDS como ducha tem sido sugerido para fornecer proteção contra vírus sexualmente transmissíveis. Além disso, no processamento do leite materno para eliminar ou reduzir a possibilidade de transmissão do HIV através da amamentação.
Além de sua ação antiviral, o SDS atua sobre bactérias e fungos patogênicos. O SDS remove a resistência aos medicamentos e os fatores de transferência de sexo de E. coli; e bloqueia o crescimento de numerosas bactérias Gram positivas.
No laboratório
O SDS se liga às proteínas causando sua desnaturação, fornecendo-lhes cargas negativas e uma mudança conformacional. Isso permite a determinação de seus pesos moleculares por eletroforese de poliacrilamida..
O SDS também é usado na preparação de amostras de tecido cerebral para uso em microscopia de luz. Também é utilizado na preparação de amostras de sangue para contagem do número de eritrócitos..
O SDS é utilizado na purificação de ácidos nucléicos, devido à sua capacidade de dissolver membranas e sua ação inibitória sobre a atividade das enzimas RNase e DNase.
Além disso, o SDS é usado na caracterização de compostos de amônio quaternário..
Aditivo alimentar
O SDS é usado como um emulsificante e espessante em alimentos. Melhora a estabilidade e textura de produtos assados. Além disso, é usado como um auxiliar na batida de ovoprodutos secos..
Indústria
O SDS é usado na indústria de galvanoplastia, principalmente níquel e zinco; como emulsificante e penetrante em removedor de vernizes e tintas; na formulação de explosivos moldados por injeção; e em propelentes de foguetes sólidos como agente de formação de espuma.
Riscos
A exposição constante ao SDS pode causar hiperplasia da pele em cobaias. Coelhos e humanos são menos suscetíveis a essas lesões. O contato direto com SDS em uma concentração ≤ 20%, pode causar inflamação moderada e irritação da pele.
Por outro lado, a exposição prolongada ao SDS pode causar dermatite, com sinais de vermelhidão, inchaço e bolhas..
O SDS pode causar irritação nos olhos em contato. Também pode ser muito reativo em algumas pessoas, causando irritação do trato respiratório e dificuldade respiratória por inalação..
Em casos raros, a ingestão de SDS pode causar lesões cáusticas. Mas, foi relatado em crianças que ingeriram SDS, desenvolvendo rapidamente vômitos profusos, depressão do SNC e dificuldade respiratória..
Nenhuma evidência de genotoxicidade ou ação teratogênica foi encontrada no SDS. Em 242 pacientes com dermatite eczematosa, 6,4% dos pacientes apresentaram alergia, atribuível ao uso do SDS.
Referências
- Dados estruturais de L.A. Smith, R. B. Hammond, K.J. Roberts, D. Machin, G. McLeod (2000). Determinação da estrutura cristalina do dodecilsulfato de sódio anidro usando uma combinação de difração de pó de radiação síncrotron e técnicas de modelagem molecular. Journal of Molecular Structure 554 (2-3): 173-182. DOI: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Dodecilsulfato de sódio. Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Dodecilsulfato de sódio. Banco de dados PubChem. CID = 3423265. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Efeito da temperatura na nanoestrutura de micelas de SDS na água. Jornal de pesquisa do Instituto Nacional de Padrões e Tecnologia, 118, 151-167. doi: 10.6028 / jres.118.008
- Elsevier. (2019). Dodecilsulfato de sódio. Science Direct. Recuperado de: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. e Tsipila, T. (2014). Efeitos toxicológicos do dodecil sulfato de sódio. Journal of Chemical and Pharmaceutical Research 6 (5): 1488-1492.
- Rede de dados toxicológicos. (s.f.). Laurilsulfato de sódio. Toxnet. Recuperado de: toxnet.nlm.nih.gov



Ainda sem comentários