
Estrutura, propriedades, usos, riscos do dióxido de enxofre (SO2)

O dióxido de enxofre é um composto inorgânico gasoso formado por enxofre (S) e oxigênio (O), sua fórmula química sendo SOdois. É um gás incolor com um odor irritante e sufocante. Além disso, é solúvel em água, formando soluções ácidas. Vulcões o expelem para a atmosfera durante as erupções.
Faz parte do ciclo biológico e geoquímico do enxofre, mas é produzido em grandes quantidades por certas atividades humanas, como o refino de petróleo e a queima de combustíveis fósseis (carvão ou diesel, por exemplo).

O entãodois é um agente redutor que permite que a polpa de papel permaneça branca após o branqueamento com outros compostos. Também serve para remover vestígios de cloro na água que foi tratada com este produto químico.
É usado para conservar alguns tipos de alimentos, para desinfetar recipientes onde é feita a fermentação do suco de uva para produzir vinho ou cevada para fazer cerveja..
É também utilizado como fungicida na agricultura, para obtenção de ácido sulfúrico, como solvente e como intermediário em reações químicas..
O entãodois presente na atmosfera é prejudicial a muitas plantas, na água atinge peixes e também é uma das responsáveis pela “chuva ácida” que corrói materiais produzidos pelo homem.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Solubilidade
- 3,7 pH
- 3.8 Propriedades químicas
- 3.9 Soluções aquosas de SO2
- 3.10 Outras propriedades
- 4 Obtendo
- 5 Presença na natureza
- 6 usos
- 6.1 Na produção de ácido sulfúrico
- 6.2 Na indústria de alimentos processados
- 6.3 Como solvente e reagente
- 6.4 Como agente redutor
- 6.5 Em várias aplicações
- 7 Efeitos do SO2 endógeno
- 8 riscos
- 8.1 Ecotoxicidade
- 8.2 Efeitos de ingeri-lo com alimentos
- 9 referências
Estrutura
A molécula de dióxido de enxofre é simétrica e forma um ângulo. O ângulo é devido ao SOdois Possui um par de elétrons solitários, ou seja, elétrons que não se ligam a nenhum átomo, mas são livres.
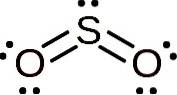
Nomenclatura
- Dióxido de enxofre
- Anidrido de enxofre
- Óxido sulfuroso.
Propriedades
Estado físico
Gás incolor.
Peso molecular
64,07 g / mol
Ponto de fusão
-75,5 ºC
Ponto de ebulição
-10,05 ºC
Densidade
Gás: 2,26 a 0 ° C (em relação ao ar, ou seja, densidade do ar = 1). Isso significa que é mais pesado que o ar..
Líquido: 1,4 a -10 ° C (em relação à água, ou seja, densidade da água = 1).
Solubilidade
Solúvel em água: 17,7% a 0 ° C; 11,9% a 15 ° C; 8,5% a 25 ° C; 6,4% a 35 ° C.
Solúvel em etanol, éter dietílico, acetona e clorofórmio. É menos solúvel em solventes não polares.
pH
Soluções aquosas de SOdois eles são ácidos.
Propriedades quimicas
O entãodois é um poderoso agente redutor e oxidante. Na presença de ar e um catalisador, oxida a SO3.
SWdois + OUdois → SO3
Os pares solitários de elétrons às vezes fazem com que ele se comporte como uma base de Lewis, ou seja, pode reagir com compostos onde há um átomo sem elétrons.
Se o sistema operacionaldois está na forma de um gás e seco não ataca ligas de ferro, aço, cobre-níquel ou níquel-cromo-ferro. No entanto, se estiver no estado líquido ou úmido, causa corrosão nesses metais..
O entãodois líquido com 0,2% de água ou mais produz forte corrosão do ferro, latão e cobre. É corrosivo para o alumínio.
Quando é líquido, também pode atacar alguns plásticos, borrachas e revestimentos.
Soluções SO aquosasdois
O entãodois é muito solúvel em água. Por muito tempo considerou-se que na água forma ácido sulfuroso HdoisSW3, mas a existência deste ácido não foi provada.
Em soluções de sistema operacionaldois na água ocorrem os seguintes equilíbrios:
SWdois + HdoisO ⇔ SOdois.HdoisOU
SWdois.HdoisO ⇔ HSO3- + H3OU+
HSO3- + HdoisO ⇔ SO3dois- + H3OU+
Onde HSO3- é o íon bissulfito e SO3dois- é o íon sulfito. O íon sulfito SO3dois- ocorre principalmente quando um álcali é adicionado à solução de SOdois.
Soluções aquosas de SOdois possuem propriedades redutoras, especialmente se forem alcalinas.
Outras propriedades
- É extremamente estável ao calor, mesmo até 2.000 ° C.
- Não é inflamável.
Obtendo
O entãodois É obtido pela combustão do enxofre (S) no ar, embora pequenas quantidades de SO também sejam formadas3.
S + Odois → SOdois
Também pode ser produzido aquecendo vários sulfetos no ar, queimando minerais de pirita e minerais contendo sulfetos, entre outros..
No caso da pirita de ferro, quando oxidada, obtém-se o óxido de ferro (iii) e o SO.dois:
4 FeSdois + 11 Odois → 2 FedoisOU3 + 8 SOdois↑
Presença na natureza
O entãodois É liberado na atmosfera pela atividade de vulcões (9%), mas também é causado por outras atividades naturais (15%) e por ações humanas (76%).
Erupções vulcânicas explosivas causam flutuações anuais significativas ou variações no SOdois na atmosfera. Estima-se que 25% do SOdois emitido por vulcões é levado pela chuva antes de atingir a estratosfera.
As fontes naturais são as mais abundantes e devem-se ao ciclo biológico do enxofre.
Nas áreas urbanas e industriais predominam as fontes humanas. A principal atividade humana que a produz é a queima de combustíveis fósseis, como carvão, gasolina e diesel. Outras fontes humanas são refinarias de petróleo, fábricas de produtos químicos e produção de gás.

Em mamíferos, é gerado endogenamente, ou seja, dentro do corpo de animais e humanos devido ao metabolismo de aminoácidos contendo enxofre (S), especialmente L-cisteína..
Formulários
Na produção de ácido sulfúrico
Uma das aplicações mais importantes do SOdois está na obtenção de ácido sulfúrico HdoisSW4.
2 SOdois + 2 hdoisO + Odois → 2 HdoisSW4
Na indústria de alimentos processados
O dióxido de enxofre é usado como conservante e estabilizador de alimentos, como agente de controle de umidade e como modificador de sabor e textura em certos produtos comestíveis..
Também é usado para desinfetar equipamentos que entram em contato com alimentos, equipamentos de fermentação, como os de cervejarias e vinícolas, recipientes de alimentos, etc..
Permite conservar frutas e vegetais, aumenta seu prazo de validade, evita a perda de cor e sabor e auxilia na retenção de vitamina C (ácido ascórbico) e carotenos (precursores da vitamina A).

É usado para conservar o vinho, pois destrói bactérias, fungos e leveduras indesejadas. Também é usado para esterilizar e prevenir a formação de nitrosaminas na cerveja..

Também é usado para embeber grãos de milho, branquear o açúcar de beterraba e como antimicrobiano na fabricação de xarope de milho com alto teor de frutose..
Como solvente e reagente
Tem sido amplamente utilizado como solvente não aquoso. Embora não seja um solvente ionizante, é útil como solvente livre de prótons para certas aplicações analíticas e reações químicas..
É utilizado como solvente e reagente em síntese orgânica, intermediário na produção de outros compostos como dióxido de cloro, cloreto de acetila e na sulfonação de óleos..
Como agente redutor
É utilizado como redutor apesar de não ser tão forte, e em solução alcalina forma-se o íon sulfito, que é um redutor mais energético..
Em várias aplicações
O entãodois também é usado:
- Na agricultura como fungicida e conservante para uvas após a colheita.
- Para fazer hidrossulfitos.
- Para branquear polpa de madeira e papel, pois permite estabilizar a polpa após o branqueamento com água oxigenada HdoisOUdois; o entãodois age destruindo o HdoisOUdois restante e, assim, manter o brilho da polpa, uma vez que o HdoisOUdois pode causar uma reversão de brilho.
- Para branquear fibras têxteis e itens de vime.
- Para tratar a água, pois elimina o cloro residual que permanece após a cloração da água potável, efluente ou industrial.
- No refino de minerais e metais, como agente redutor do ferro durante o processamento mineral..
- No refino de petróleo para reter oxigênio e retardar a corrosão, e como solvente de extração.
- Como antioxidante.
- Como um neutralizador alcalino na fabricação de vidro.
- Em baterias de lítio como agente oxidante.
Efeitos do sistema operacionaldois endógeno
Certos estudos revelaram que SOdois endógeno ou produzido pelo próprio corpo tem um efeito benéfico no sistema cardiovascular, incluindo a regulação da função cardíaca e o relaxamento dos vasos sanguíneos.
Quando o SO é produzido no corpodois torna-se seus derivados bissulfito HSO3- e sulfito SO3dois-, que exercem um efeito vaso-relaxante nas artérias.
O entãodois endogenamente reduz a hipertensão, previne o desenvolvimento de aterosclerose e protege o coração de danos ao miocárdio. Também tem ação antioxidante, inibe inflamação e apoptose (morte celular programada).
Por essas razões, pensa-se que pode ser uma possível nova terapia para doenças cardiovasculares..
Riscos
- Exposição a SOdois gasoso pode causar queimaduras nos olhos, pele, garganta e membranas mucosas, danos aos brônquios e pulmões.
- Alguns estudos relatam que há risco potencial de danos ao material genético de células humanas e de mamíferos.
- É corrosivo. Não é inflamável.
Ecotoxicidade
O dióxido de enxofre é o gás poluente mais comum na atmosfera, especialmente em áreas urbanas e industriais..
Sua presença na atmosfera contribui para a chamada “chuva ácida” que é prejudicial aos organismos aquáticos, peixes, vegetação terrestre e corrosão de materiais de fabricação humana..

O entãodois é tóxico para os peixes. As plantas verdes são extremamente sensíveis ao SOdois atmosférico. Alfafa, algodão, cevada e trigo são danificados em baixos níveis ambientais, enquanto batata, cebola e milho são muito mais resistentes.
Efeitos de ingeri-lo com alimentos
Embora seja inofensivo para pessoas saudáveis, quando usado nas concentrações recomendadas por órgãos de saúde autorizados, SOdois pode induzir asma em pessoas sensíveis que o ingerem com alimentos.
Os alimentos que geralmente o contêm são frutas secas, refrigerantes artificiais e bebidas alcoólicas.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Dióxido de enxofre. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Huang, Y. et al. (2016). Dióxido de enxofre endógeno: um novo membro da família dos gasotransmissores no sistema cardiovascular. Oxid Med Cell Longev. 2016; 2016: 8961951. Recuperado de ncbi.nlm.nih.gov.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Windholz, M. et al. (editores) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. Décima edição. Merck & CO., Inc.
- Pan, X. (2011). Óxidos de enxofre: fontes, exposições e efeitos na saúde. Efeitos na saúde dos óxidos de enxofre. Na Enciclopédia de Saúde Ambiental. Recuperado de sciencedirect.com.
- Tricker, R. e Tricker, S. (1999). Poluentes e contaminantes. Dióxido de enxofre. Em Requisitos Ambientais para Equipamentos Eletromecânicos e Eletrônicos. Recuperado de sciencedirect.com.
- Bleam, W. (2017). Química ácido-base. Óxidos de enxofre. Em Soil and Environmental Chemistry (Segunda Edição). Recuperado de sciencedirect.com.
- Freedman, B.J. (1980). Dióxido de enxofre em alimentos e bebidas: seu uso como conservante e seu efeito na asma. Br J Dis Chest. 1980; 14 (2): 128-34. Recuperado de ncbi.nlm.nih.gov.
- Craig, K. (2018). Uma revisão da química, uso de pesticidas e destino ambiental do dióxido de enxofre, conforme usado na Califórnia. Em Revisões de Contaminação Ambiental e Toxicologia. Volume 246. Recuperado de link.springer.com.



Ainda sem comentários