
Características e aplicações do fosfato de diidroxiacetona (DHAP)
O fosfato de dihidroxiacetona É um composto químico abreviado pela sigla DHAP. É um intermediário em algumas vias metabólicas de organismos vivos, como a degradação glicolítica ou glicólise, bem como no ciclo de Calvin nas plantas.
Bioquimicamente, DHAP é o produto da ação de uma enzima aldolase na frutose-1,6-bifosfato (FBP), que causa uma degradação aldolítica resultando em dois compostos de três carbonos: DHAP e gliceraldeído 3-fosfato (GAP).
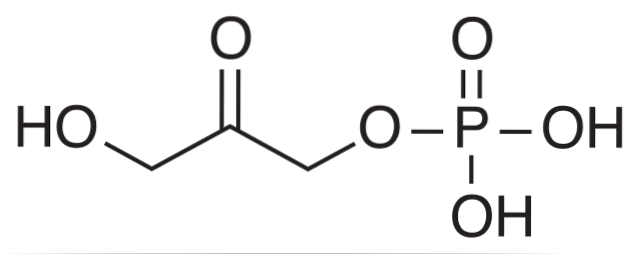
No ciclo de Calvin, a aldolase realiza a reação reversa, condensando moléculas de DHAP com moléculas de GAP para formar uma hexose..
Índice do artigo
- 1 recursos
- 2 DHAP na glicólise
- 2.1 Reação de Aldolase
- 2.2 Reação do TIM
- 3 DHAP no ciclo de Calvin
- 4 DHAP na gliconeogênese
- 5 referências
Caracteristicas
DHAP é classificado dentro das moléculas conhecidas como cetotrioses. Estes são monossacarídeos compostos por uma cadeia de três carbonos (trioses) com o grupo carbonila no carbono central (C2).
GAP e DAHP são isômeros funcionais e constituem os carboidratos mais simples dentro de moléculas orgânicas biologicamente ativas.
Embora a estrutura química de muitos carboidratos comuns, como GAP e DHAP, sejam aldeídos e cetonas, eles recebem o termo carboidrato, referindo-se a derivados diretos de sacarídeos..
DHAP em glicólise
Na glicólise, uma série de reações degradam a glicose em piruvato. Esta degradação ocorre progressivamente em 10 etapas consecutivas, onde diferentes enzimas intervêm e uma variedade de intermediários são produzidos, todos fosforilados..
O DHAP aparece na glicólise na quarta reação desse processo, que consiste na quebra do FBP em dois carboidratos de três carbonos (trioses), dos quais apenas o GAP continua a sequência da glicólise, enquanto o DHAP precisa ser transformado em GAP para seguir esta rota.
Esta reação é catalisada por uma aldolase (frutose bisfosfato aldolase), que realiza uma clivagem aldólica entre os carbonos C3 e C4 do FBP.
Essa reação ocorre apenas se a hexose a ser dividida tiver um grupo carbonila em C2 e uma hidroxila em C4. Por esse motivo, a isomerização da glicose-6-fosfato (G6P) em frutose 6-fosfato (F6P) ocorre anteriormente..
O DHAP também está envolvido na quinta reação da glicólise, sendo sua isomerização para GAP pela enzima triose fosfato isomerase ou TIM. Com esta reação, a primeira fase de degradação da glicose é concluída..
Reação de aldolase
Na quebra do aldol, dois intermediários são produzidos, onde o DHAP compõe 90% da mistura em equilíbrio.
Existem dois tipos de aldolases: a) a aldolase tipo I está presente em células animais e vegetais e é caracterizada pela formação de uma base de Schiff entre o sítio ativo enzimático e a carbonila do FBP. b) A aldolase tipo II é encontrada em algumas bactérias e fungos, tem um metal no sítio ativo (geralmente Zn).
A clivagem do aldol começa com a adesão do substrato ao sítio ativo e a retirada de um próton do grupo β-hidroxila, formando a base de Schiff protonada (cátion imínio). A quebra dos carbonos C3 e C4 produz a liberação de GAP e a formação de um intermediário chamado enamina..
A enamina é posteriormente estabilizada, então um cátion imínio é formado que é hidrolisado, com o qual o DHAP é finalmente liberado e a enzima livre é regenerada.
Em células com aldolase tipo II, a formação da base de Schiff não ocorre, sendo um cátion metálico divalente, geralmente Zn.dois+, aquele que estabiliza a enamina intermediária para liberar DHAP.
Reação TIM
Como mencionado, a concentração de equilíbrio de DHAP é maior do que a de GAP, de modo que as moléculas de DHAP estão sendo transformadas em GAP, pois o último é usado na seguinte reação de glicólise..
Essa transformação ocorre graças à enzima TIM. Esta é a quinta reação do processo de degradação glicolítica e nela os carbonos C1 e C6 da glicose tornam-se os carbonos C3 do GAP, enquanto os carbonos C2 e C5 tornam-se C2 e C3 e C4 da glicose tornam-se C1 do GAP.
A enzima TIM é considerada a "enzima perfeita" porque a difusão controla a velocidade da reação, o que significa que o produto é formado tão rapidamente quanto o sítio ativo da enzima e seu substrato se unem..
Na reação de transformação de DHAP em GAP, um intermediário chamado enediol é formado. Este composto é capaz de ceder os prótons dos grupos hidroxila a um resíduo do sítio ativo da enzima TIM..
DHAP no ciclo de Calvin
O ciclo de Calvin é o ciclo de redução do carbono fotossintético (PCR) que constitui a fase escura do processo de fotossíntese nas plantas. Nessa etapa, os produtos (ATP e NADPH) obtidos na fase leve do processo são utilizados para a fabricação de carboidratos..
Nesse ciclo, são formadas seis moléculas de GAP, das quais duas são transformadas em DHAP por isomerização, graças à ação da enzima TIM, em reação inversa à que ocorre na degradação da glicólise. Esta reação é reversível, embora o equilíbrio, no caso deste ciclo e, ao contrário da glicólise, seja desviado para a conversão de GAP em DHAP.
Essas moléculas de DHAP podem então seguir duas vias, uma delas é uma condensação aldólica catalisada por uma aldolase, na qual ela condensa com uma molécula GAP para formar FBP.
A outra reação que um dos DHAPs pode ter é uma hidrólise de fosfato catalisada por uma bifosfatase de sedoheptulose. Nesta última rota, ele reage com uma eritrose para formar sedoheptulose 1,7-bifosfato.
DHAP na gliconeogênese
Na gliconeogênese, alguns compostos não glucídicos como o piruvato, o lactato e alguns aminoácidos são convertidos em glicose. Nesse processo, o DHAP reaparece por meio da isomerização de uma molécula de GAP pela ação do TIM, e então por condensação aldólica, torna-se FBP.
Referências
- Bailey, P. S., & Bailey, C. A. (1998). Química orgânica: conceitos e aplicações. Ed. Pearson Education.
- Devlin, T. M. (1992). Livro didático de bioquímica: com correlações clínicas. John Wiley & Sons, Inc.
- Garrett, R. H., & Grisham, C. M. (2008). Bioquímica. Ed. Thomson Brooks / Cole.
- Nelson, D. L., & Cox, M. M. (2006). Lehninger Principles of Biochemistry 4ª edição. Ed Omega. Barcelona.
- Rawn, J. D. (1989). Bioquímica (No. 577.1 RAW). Ed. Interamericana-McGraw-Hill
- Voet, D., & Voet, J. G. (2006). Bioquímica. Panamerican Medical Ed..


Ainda sem comentários