
Diagrama de Moeller do que consiste e exercícios resolvidos
O Diagrama de Moeller o O método Rain é um método gráfico e mnemônico para aprender a regra de Madelung; isto é, como escrever a configuração eletrônica de um elemento. É caracterizada por traçar diagonais através das colunas dos orbitais, e seguindo a direção da seta, é estabelecida a ordem apropriada da mesma para um átomo..
Em algumas partes do mundo, o diagrama de Moeller também é conhecido como o método de chuva. Com isso, é definida uma ordem no preenchimento dos orbitais, que também são definidos pelos três números quânticos. n, eu Y ml.
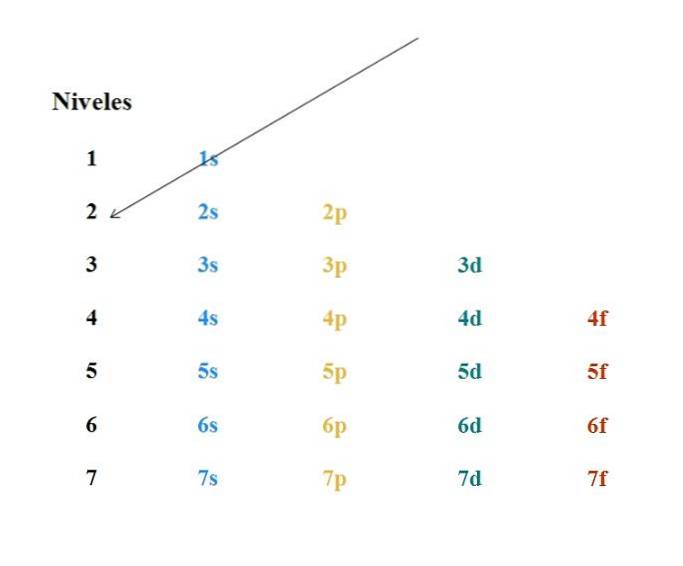
Um diagrama de Moeller simples é mostrado na imagem acima. Cada coluna corresponde a diferentes orbitais: s, p, d e f, com seus respectivos níveis de energia. A primeira seta indica que o preenchimento de qualquer átomo deve começar com o orbital 1s.
Assim, a próxima seta deve começar do orbital 2s e, em seguida, do orbital 2p até o orbital 3s. Desta forma, como se fosse uma chuva, os orbitais e a quantidade de elétrons que eles contêm (4eu+dois).
O diagrama de Moeller representa uma introdução para aqueles que estudam as configurações eletrônicas..
Índice do artigo
- 1 O que é o diagrama de Moeller?
- 1.1 Regra de Madelung
- 1.2 Passos a seguir
- 2 exercícios resolvidos
- 2.1 Berílio
- 2.2 Fósforo
- 2,3 Zircônio
- 2.4 Iridium
- 2.5 Exceções ao diagrama de Moeller e à regra de Madelung
- 3 referências
Qual é o diagrama de Moeller?
Regra de Madelung
Como o diagrama de Moeller consiste em uma representação gráfica da regra de Madelung, é necessário saber como esta funciona. O preenchimento dos orbitais deve obedecer às duas seguintes regras:
-Os orbitais com os menores valores de n+eu são preenchidos primeiro, sendo n o número quântico principal, e eu o momento angular orbital. Por exemplo, o orbital 3d corresponde a n= 3 e eu= 2, portanto, n+eu= 3 + 2 = 5; enquanto isso, o orbital 4s corresponde a n= 4 e eu= 0, e n+eu= 4 + 0 = 4. Do exposto, é estabelecido que os elétrons preenchem o orbital 4s primeiro do que o 3d.
-Se dois orbitais têm o mesmo valor de n+eu, os elétrons ocuparão primeiro aquele com o menor valor de n. Por exemplo, o orbital 3d tem um valor de n+eu= 5, como o orbital 4p (4 + 1 = 5); mas como 3d tem o menor valor de n, vai encher antes das 4p.
A partir das duas observações anteriores, a seguinte ordem de preenchimento dos orbitais pode ser alcançada: 1s 2s 2p 3s 3p 4s 3d 4p.
Seguindo as mesmas etapas para diferentes valores de n+eu para cada orbital são obtidas as configurações eletrônicas de outros átomos; que por sua vez também pode ser determinado graficamente pelo diagrama de Moeller.
Passos a seguir
A regra de Madelung estabelece a fórmula n+eu, com o qual a configuração eletrônica pode ser "armada". No entanto, como mencionado, o diagrama de Moeller já representa isso graficamente; então basta seguir suas colunas e desenhar diagonais passo a passo.
Como então você inicia a configuração eletrônica de um átomo? Para fazer isso, você deve primeiro saber seu número atômico Z, que por definição para um átomo neutro é igual ao número de elétrons.
Assim, com Z o número de elétrons é obtido, e com isso em mente começamos a desenhar diagonais através do diagrama de Moeller..
Os orbitais s podem acomodar dois elétrons (aplicando a fórmula 4eu+2), o p seis elétrons, o d dez e o f catorze. Ele para no orbital onde o último elétron dado por Z foi ocupado.
Para maiores esclarecimentos, segue abaixo uma série de exercícios resolvidos.
Exercícios resolvidos
Berílio
Usando a tabela periódica, o elemento berílio está localizado com um Z = 4; ou seja, seus quatro elétrons devem ser acomodados nos orbitais.
Começando então com a primeira seta no diagrama de Moeller, o orbital 1s ocupa dois elétrons: 1sdois; seguido pelo orbital 2s, com dois elétrons adicionais para somar 4 no total: 2sdois.
Portanto, a configuração eletrônica do berílio, expressa como [Be] é 1sdois2sdois. Observe que a soma dos sobrescritos é igual ao número total de elétrons.
Partida
O elemento fósforo tem um Z = 15 e, portanto, tem 15 elétrons no total que devem ocupar os orbitais. Para avançar no caminho, você começa imediatamente com a configuração 1sdois2sdois, que contém 4 elétrons. Então, mais 9 elétrons estariam faltando.
Após o orbital 2s, a próxima seta "entra" pelo orbital 2p, finalmente pousando no orbital 3s. Como os orbitais 2p podem ocupar 6 elétrons e os 3s 2 elétrons, temos: 1sdois2sdois2 P63sdois.
Ainda faltam mais 3 elétrons, que ocupam o seguinte orbital 3p de acordo com o diagrama de Moeller: 1sdois2sdois2 P63sdois3p3, configuração eletrônica do fósforo [P].
Zircônio
O elemento zircônio tem um Z = 40. Encurtando caminho com configuração 1sdois2sdois2 P63sdois3p6, com 18 elétrons (o do gás nobre argônio), faltariam mais 22 elétrons. Após o orbital 3p, os próximos a preencher de acordo com o diagrama de Moeller são os orbitais 4s, 3d, 4p e 5s.
Preenchendo-os completamente, ou seja, 4sdois, 3d10, 4p6 e 5sdois, um total de 20 elétrons são adicionados. Os 2 elétrons restantes estão, portanto, alojados no seguinte orbital: o 4d. Assim, a configuração eletrônica do zircônio, [Zr] é: 1sdois2sdois2 P63sdois3p64sdois3d104p65sdois4ddois.
Iridium
O irídio tem um Z = 77, portanto, tem 37 elétrons adicionais em comparação com o zircônio. A partir de [Cd], ou seja, 1sdois2sdois2 P63sdois3p64sdois3d104p65sdois4d10, adicione 29 elétrons com os seguintes orbitais do diagrama de Moeller.
Desenhando novas diagonais, os novos orbitais são: 5p, 6s, 4f e 5d. Preenchendo os três primeiros orbitais completamente, temos: 5p6, 6sdois e 4f14, para dar um total de 22 elétrons.
Portanto, faltam 7 elétrons, que estão no orbital 5d: 1s.dois2sdois2 P63sdois3p64sdois3d104p65sdois4d105 p66sdois4f145 d7.
O acima é a configuração eletrônica do irídio, [Go]. Observe que os orbitais 6sdois e 5d7 estão destacados em negrito para indicar que correspondem adequadamente à camada de valência deste metal.
Exceções ao diagrama de Moeller e à regra de Madelung
Muitos elementos da tabela periódica não obedecem ao que acaba de ser explicado. Suas configurações eletrônicas diferem experimentalmente daquelas previstas por razões quânticas..
Entre los elementos que presentan estas discordancias son: cromo (Z=24), cobre (Z=29), plata (Z=47), rodio (Z=45), cerio (Z=58), niobio (Z=41) e muitos mais.
Exceções são muito frequentes no preenchimento dos orbitais d e f. Por exemplo, o cromo deve ter uma configuração de valência de 4sdois3d4 de acordo com o diagrama de Moeller e a regra de Madelung, mas na verdade é 4s13d5.
Além disso, e finalmente, a configuração de valência de prata deve ser 5sdois4d9; mas é realmente 5s14d10.
Referências
- Gavira J. Vallejo M. (6 de agosto de 2013). Exceções à regra de Madelung e ao diagrama de Moeller na configuração eletrônica de elementos químicos. Recuperado de: triplenlace.com
- Minha superclasse. (s.f.) O que é configuração eletrônica? Recuperado de: misuperclase.com
- Wikipedia. (2018). Diagrama de Moeller. Recuperado de: es.wikipedia.org
- Bobos. (2018). Como representar elétrons em um diagrama de nível de energia. Recuperado de: dummies.com
- Nave R. (2016). Ordem de Preenchimento de Estados de Elétrons. Recuperado de: hyperphysics.phy-astr.gsu.edu

Ainda sem comentários