
Propriedades, usos e exemplos de derivados halogenados

O derivados halogenados são todos aqueles compostos que têm um átomo de halogênio; ou seja, qualquer um dos elementos do grupo 17 (F, Cl, Br, I). Esses elementos diferem dos demais por serem mais eletronegativos, formando uma diversidade de haletos orgânicos e inorgânicos..
A imagem abaixo mostra as moléculas gasosas dos halogênios. De cima para baixo: flúor (Fdois), cloro (Cldois), bromo (Brdois) e iodo (Idois) Cada um deles tem a capacidade de reagir com a grande maioria dos elementos, mesmo entre congêneres do mesmo grupo (interhalogênios).
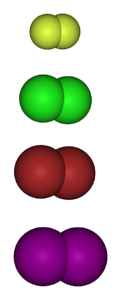
Assim, os derivados halogenados têm a fórmula MX se for um halogeneto de metal, RX se for alquil e ArX se for aromático. Os dois últimos estão na categoria de haletos orgânicos. A estabilidade desses compostos requer um "benefício" de energia em comparação com a molécula de gás original.
Como regra geral, o flúor forma derivados halogenados mais estáveis do que o iodo. O motivo é devido às diferenças entre seus raios atômicos (as esferas roxas são mais volumosas que as amarelas).
À medida que o raio atômico aumenta, a sobreposição dos orbitais entre o halogênio e o outro átomo é mais pobre e, portanto, a ligação é mais fraca..
Índice do artigo
- 1 Nomenclatura
- 1.1 Inorgânicos
- 1.2 Orgânico
- 2 propriedades
- 2.1 Haletos inorgânicos
- 2.2 Halogenetos orgânicos
- 3 usos
- 4 exemplos adicionais
- 5 referências
Nomenclatura
A forma correta de nomear esses compostos depende se eles são inorgânicos ou orgânicos..
Inorgânico
Halogenetos metálicos consistem em uma ligação, iônica ou covalente, entre um halogênio X e um metal M (dos grupos 1 e 2, metais de transição, metais pesados, etc.).
Nestes compostos, todos os halogênios têm um estado de oxidação de -1. Por quê? Porque suas configurações de valência são nsdoisnp5.
Portanto, eles precisam ganhar apenas um elétron para completar o octeto de valência, enquanto os metais se oxidam, dando-lhes os elétrons disponíveis..
Assim, o flúor permanece como F-, fluoreto; o Cl-, cloreto; o BR-, brometo; e eu-, Eu durar. MF seria denominado: (nome do metal) fluoreto (n), onde n é a valência do metal apenas quando possui mais de um. Para o caso de metais dos grupos 1 e 2, não é necessário nomear a valência.
Exemplos
- NaF: fluoreto de sódio.
- CaCldois: cloreto de cálcio.
- AgBr: brometo de prata.
- ZnIdois: iodeto de zinco.
- CuCl: cloreto de cobre (I).
- CuCldois: cloreto de cobre (II).
- TiCl4: cloreto de titânio (IV) ou tetracloreto de titânio.
No entanto, hidrogênio e elementos não metálicos - até mesmo os próprios halogênios - também podem formar haletos. Nestes casos, a valência do não metal não é nomeada no final:
- PCl5: pentacloreto de fósforo.
- BF3: trifluoreto de boro.
- Todos3: triiodeto de alumínio.
- HBr: brometo de hidrogênio.
- E SE7: heptafluoreto de iodo.
Orgânico
Independentemente de ser RX ou ArX, o halogênio está covalentemente ligado a um átomo de carbono. Nestes casos, os halogênios são mencionados por seus nomes, e o resto da nomenclatura depende da estrutura molecular de R ou Ar.
Para a molécula orgânica mais simples, metano (CH4), os seguintes derivados são obtidos substituindo H por Cl:
- CH3Cl: clorometano.
- CHdoisCldois: diclorometano.
- CHCl3: triclorometano (clorofórmio).
- CCl4: tetraclorometano (cloreto de carbono (IV) ou tetracloreto de carbono).
Aqui, R consiste em um único átomo de carbono. Assim, para outras cadeias alifáticas (lineares ou ramificadas), é contado o número de carbonos dos quais está ligada ao halogênio:
CH3CHdoisCHdoisF: 1-fluoropropano.
O exemplo acima foi o de um halogeneto de alquil primário. No caso de a cadeia ser ramificada, a cadeia mais longa contendo o halogênio é escolhida e a contagem começa, deixando o menor número possível:
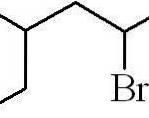
3-metil-5-bromohexano
O mesmo acontece com outros substituintes. Da mesma forma, para haletos aromáticos, o halogênio é nomeado e, em seguida, o resto da estrutura:
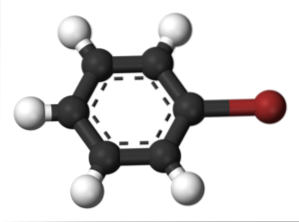
A imagem superior mostra o composto chamado bromobenzeno, destacando o átomo de bromo em marrom.
Propriedades
Haletos inorgânicos
Os haletos inorgânicos são sólidos iônicos ou moleculares, embora os primeiros sejam mais abundantes. Dependendo das interações e raios iônicos de MX, será solúvel em água ou outros solventes menos polares.
Os haletos não metálicos (como os haletos de boro) são geralmente ácidos de Lewis, o que significa que eles aceitam elétrons para formar complexos. Por outro lado, os haletos de hidrogênio (ou haletos) dissolvidos em água produzem o que são conhecidos como hidrácidos..
Seus pontos de fusão, ebulição ou sublimação recaem nas interações eletrostáticas ou covalentes entre o metal ou não-metal com o halogênio..
Da mesma forma, os raios iônicos desempenham um papel importante nessas propriedades. Por exemplo, se M+ e X- têm tamanhos semelhantes, seus cristais serão mais estáveis.
Haletos orgânicos
Eles são polares. Por quê? Porque a diferença de eletronegatividades entre C e halogênio cria um momento polar permanente na molécula. Da mesma forma, isso diminui conforme o grupo 17 desce, da ligação C-F para C-I.
Independentemente da estrutura molecular de R ou Ar, o aumento do número de halogênios afeta diretamente os pontos de ebulição, pois aumentam a massa molar e as interações intermoleculares (RC-X-X-CR). A maioria é imiscível com água, mas pode se dissolver em solventes orgânicos.
Formulários
Os usos dos derivados halogenados podem reservar seu próprio texto. Os "parceiros" moleculares dos halogênios são um fator chave, uma vez que suas propriedades e reatividades definem os usos do derivado..
Assim, entre a grande diversidade de utilizações possíveis, destacam-se:
- Halogênios moleculares são usados para criar lâmpadas halógenas, onde entram em contato com o filamento incandescente de tungstênio. O objetivo dessa mistura é fazer reagir o halogênio X com o tungstênio evaporado. Desta forma, evita-se sua deposição na superfície do bulbo, garantindo um maior tempo de vida..
- Sais de flúor são usados na fluoretação de água e cremes dentais.
- Os hipocloritos de sódio e cálcio são dois agentes ativos em soluções de branqueamento comerciais (cloro)..
- Embora danifiquem a camada de ozônio, os clorofluorcarbonos (CFCs) são usados em aerossóis e sistemas de refrigeração..
- Cloreto de vinil (CHdois= CHCl) é o monômero do polímero de cloreto de polivinila (PVC). Por outro lado, o Teflon, usado como um material antiaderente, consiste em cadeias poliméricas de tetrafluoroetileno (FdoisC = CFdois).
- Eles são usados em química analítica e em sínteses orgânicas para diferentes fins; entre estes, a síntese de drogas.
Exemplos adicionais
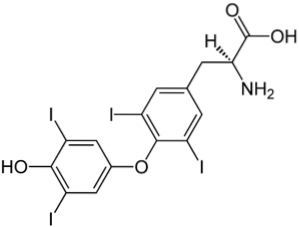
A imagem superior ilustra o hormônio tireoidiano, responsável pela produção de calor e também pelo aumento do metabolismo geral do corpo. Este composto é um exemplo de um derivado halogenado presente no corpo humano.
Entre outros compostos halogenados, são mencionados os seguintes:
- Diclorodifeniltricloroetano (DDT), inseticida eficiente, mas com graves impactos ambientais.
- Cloreto de estanho (SnCldois), usado como um agente redutor.
- Cloroetano ou 1-cloroetano (CH3CHdoisCl), um anestésico tópico que age rapidamente resfriando a pele.
- Dicloroetileno (ClCH = CClH) e tetracloroetileno (CldoisC = CCldois), usado como solventes na indústria de lavagem a seco.
Referências
- Dr. Ian Hunt. Nomenclatura orgânica IUPAC básicaHaloalcanos / halogenetos de alquila. Obtido em 04 de maio de 2018, em: chem.ucalgary.ca
- Richard C. Banks. (Agosto de 2000). Nomenclatura de Haletos Orgânicos. Obtido em 04 de maio de 2018, em: chemical.boisestate.edu
- Advameg, Inc. (2018). Compostos orgânicos de halogênio. Obtido em 4 de maio de 2018, em: chemicalexplained.com
- Compostos orgânicos de halogênio. Obtido em 04 de maio de 2018, em: 4college.co.uk
- Dr. Seham Alterary. (2014). Compostos orgânicos de halogênio. Obtido em 04 de maio de 2018, em: fac.ksu.edu.sa
- Clark J. Physical Properties of Alkyl Halides. Obtido em 04 de maio de 2018, em: chem.libretexts.org
- Dr. Manal K. Rasheed. Haletos orgânicos. Obtido em 4 de maio de 2018, em: comed.uobaghdad.edu.iq


Ainda sem comentários