
Expressão de concentração química, unidades, molalidade

O concentração química é a medida numérica da quantidade relativa de soluto em uma solução. Esta medida expressa uma razão do soluto para uma quantidade ou volume do solvente ou solução em unidades de concentração. O termo "concentração" está relacionado à quantidade de soluto presente: uma solução será mais concentrada quanto mais soluto tiver.
Essas unidades podem ser físicas quando são levadas em consideração as magnitudes de massa e / ou volume da solução ou dos componentes químicos, quando a concentração do soluto é expressa em seus moles ou equivalentes, tomando como referência o número de Avogadro..

Assim, usando pesos moleculares ou atômicos e o número de Avogadro, é possível converter unidades físicas em unidades químicas ao expressar a concentração de um determinado soluto. Portanto, todas as unidades podem ser convertidas para a mesma solução.
Índice do artigo
- 1 Soluções diluídas e concentradas
- 2 maneiras de expressar concentração
- 2.1 Descrição qualitativa
- 2.2 Classificação por solubilidade
- 2.3 Notação quantitativa
- 3 unidades de concentração
- 3.1 Unidades de concentração relativa
- 3.2 Unidades de concentração diluída
- 3.3 Unidades de concentração em função de moles
- 3.4 Formalidade e normalidade
- 4 molaridade
- 4.1 Exercício 1
- 4.2 Exercício 2
- 5 normalidade
- 5.1 Cálculo
- 5.2 Exercício 1
- 6 molalidade
- 6.1 Exercício 1
- 7 Notas e recomendações importantes sobre concentração química
- 7.1 O volume da solução é sempre maior que o do solvente
- 7.2 Utilidade da molaridade
- 7.3 As fórmulas não são memorizadas, mas as unidades ou definições são
- 8 referências
Soluções diluídas e concentradas
Como saber se uma concentração está muito diluída ou concentrada? À primeira vista, pela manifestação de qualquer uma de suas propriedades organolépticas ou químicas; isto é, aqueles que os sentidos percebem ou que podem ser medidos.
A imagem acima mostra uma diluição de uma concentração de dicromato de potássio (KdoisCrdoisOU7), que exibe uma cor laranja. Da esquerda para a direita você pode ver como a cor diminui sua intensidade conforme a concentração é diluída, adicionando mais solvente.
Esta diluição permite obter desta forma uma concentração diluída a partir de uma concentrada. A cor (e outras propriedades "ocultas" em seu núcleo laranja) muda da mesma forma que sua concentração, seja com unidades físicas ou químicas..
Mas quais são as unidades químicas de concentração? Entre eles estão a molaridade ou concentração molar de uma solução, que relaciona os moles de soluto pelo volume total da solução em litros.
Há também a molalidade ou também chamada de concentração molal, que se refere aos moles de soluto, mas que estão contidos em uma quantidade padronizada de solvente ou solvente que é exatamente um quilograma.
Este solvente pode ser puro ou se a solução contiver mais de um solvente, a molalidade será os moles de soluto por quilograma da mistura de solventes..
E a terceira unidade de concentração química é a normalidade ou concentração normal de uma solução que expressa o número de equivalentes químicos do soluto por litro da solução.
A unidade em que a normalidade é expressa é em equivalentes por litro (Eq / L) e na medicina a concentração de eletrólitos no soro humano é expressa em miliequivalentes por litro (mEq / L).
Formas de expressar concentração

A concentração de uma solução pode ser denotada de três maneiras principais, embora tenham uma grande variedade de termos e unidades próprias, que podem ser usados para expressar a medida desse valor: descrição qualitativa, notação quantitativa e classificação em termos de solubilidade..
Dependendo do idioma e do contexto em que você está trabalhando, uma das três formas será escolhida para expressar a concentração de uma mistura.
Descrição qualitativa
Usada principalmente em linguagem informal e não técnica, a descrição qualitativa da concentração de uma mistura se expressa na forma de adjetivos, que indicam de forma generalizada o nível de concentração que uma solução possui..
Desta forma, o nível de concentração mínimo de acordo com a descrição qualitativa é o de uma solução “diluída” e o máximo é o de uma solução “concentrada”..
Falamos de soluções diluídas quando uma solução tem uma proporção muito baixa de soluto em função do volume total da solução. Se você quiser diluir uma solução, deve adicionar mais solvente ou encontrar uma maneira de reduzir o soluto.
Agora, falamos de soluções concentradas quando elas possuem uma alta proporção de soluto em função do volume total da solução. Para concentrar uma solução, você deve adicionar mais soluto ou reduzir a quantidade de solvente.
Nesse sentido, essa classificação é chamada de descrição qualitativa, não só por carecer de medidas matemáticas, mas também por sua qualidade empírica (pode ser atribuída a características visuais, cheiros e gostos, sem a necessidade de testes científicos)..
Classificação por solubilidade
A solubilidade de uma concentração denota a capacidade máxima de soluto que uma solução possui, dependendo de condições como temperatura, pressão e as substâncias que estão dissolvidas ou em suspensão..
As soluções podem ser classificadas em três tipos de acordo com seu nível de soluto dissolvido no momento da medição: soluções insaturadas, saturadas e supersaturadas..
- Soluções insaturadas são aquelas que contêm menos soluto do que a solução pode dissolver. Neste caso, a solução não atingiu sua concentração máxima.
- Soluções saturadas são aquelas em que a quantidade máxima possível de soluto foi dissolvida no solvente a uma temperatura específica. Neste caso, há um equilíbrio entre as duas substâncias e a solução não pode aceitar mais soluto (pois irá precipitar).
- Soluções supersaturadas têm mais soluto do que a solução aceitaria em condições de equilíbrio. Isso é feito aquecendo uma solução saturada, adicionando mais soluto do que o normal. Uma vez frio, não precipitará o soluto automaticamente, mas qualquer perturbação pode causar este efeito devido à sua instabilidade..
Notação quantitativa
No estudo de uma solução para uso no campo técnico ou científico, é necessária uma precisão medida e expressa em unidades, que descreva a concentração de acordo com seus valores exatos de massa e / ou volume..
É por isso que existe uma série de unidades usadas para expressar a concentração de uma solução em sua notação quantitativa, que são divididas em físicas e químicas, e que por sua vez têm suas próprias subdivisões..
As unidades de concentração física são as de "concentração relativa", expressas em percentagens. Existem três maneiras de expressar as concentrações percentuais: porcentagens de massa, porcentagens de volume e porcentagens de massa-volume..
Em vez disso, as unidades de concentrações químicas são baseadas em quantidades molares, equivalentes em gramas, partes por milhão e outras características do soluto em relação à solução..
Estas unidades são as mais comuns devido à sua alta precisão na medição de concentrações, por isso costumam ser aquelas que se deseja saber para trabalhar com soluções químicas..
Unidades de concentração
Conforme descrito nas seções anteriores, ao caracterizar quantitativamente a concentração de uma solução, os cálculos devem ser regidos pelas unidades existentes para esse fim..
Da mesma forma, as unidades de concentração são divididas em concentração relativa, concentração diluída, base em moles e outras adicionais..
Unidades de concentração relativa
As concentrações relativas são aquelas expressas em porcentagens, conforme mencionadas na seção anterior. Essas unidades são divididas em porcentagem de massa-massa, porcentagem de volume-volume e porcentagem de massa-volume, e são calculadas da seguinte forma:
- % massa = massa do soluto (g) / massa da solução total (g) x 100
- % de volume = volume de soluto (ml) / volume de solução total (ml) x 100
- % massa / volume = massa do soluto (g) / volume da solução total (ml) x 100
Nesse caso, para calcular a massa ou o volume da solução total, a massa ou o volume do soluto deve ser somado com o do solvente..
Unidades de concentração diluída
As unidades de concentração diluída são aquelas usadas para expressar aquelas concentrações muito pequenas que são encontradas na forma de traços dentro de uma solução diluída; o uso mais comum dessas unidades é encontrar vestígios de um gás dissolvido em outro, como agentes que poluem o ar.
Essas unidades são indicadas na forma de partes por milhão (ppm), partes por bilhão (ppb) e partes por trilhão (ppt) e são expressas da seguinte forma:
- ppm = 1 mg de soluto / 1 L de solução
- ppb = 1 μg de soluto / 1 L de solução
- ppt = 1 ng de soluto / 1 L de solução
Nessas expressões, mg é igual a miligramas (0,001 g), μg é igual a microgramas (0,000001 g) e ng é igual a nanogramas (0,000000001 g). Essas unidades também podem ser expressas como uma função de volume / volume.
Unidades de concentração em função de moles
As unidades de concentração baseadas em moles são aquelas da fração molar, a porcentagem molar, a molaridade e a molalidade (as duas últimas são melhor descritas no final do artigo).
A fração molar de uma substância é a fração de todas as suas moléculas constituintes (ou átomos) em função do total de moléculas ou átomos. É calculado da seguinte forma:
XPARA = número de mols da substância A / número total de mols na solução
Este procedimento é repetido para as demais substâncias em solução, levando em consideração que a soma de XPARA + XB + XC ... deve ser igual a um.
A porcentagem de mol é trabalhada de maneira semelhante a XPARA, apenas como uma porcentagem:
Porcentagem molar de A = XPARA x 100%
A seção final discutirá a molaridade e a molalidade em detalhes..
Formalidade e normalidade
Por fim, há duas unidades de concentração atualmente em desuso: formalidade e normalidade..
A formalidade de uma solução representa o número de peso-fórmula-grama por litro de solução total. É expresso como:
F = No. P.F.G / L solução
Nesta expressão P.F.G é igual ao peso de cada átomo da substância, expresso em gramas.
Em vez disso, a normalidade representa o número de equivalentes de soluto dividido por litros de solução, conforme expresso a seguir:
N = gramas equivalentes de soluto / L solução
Nesta expressão, os gramas equivalentes de soluto podem ser calculados pelo número de moles H+, Oh- ou outros métodos, dependendo do tipo de molécula.
Molaridade
A molaridade ou concentração molar de um soluto é a unidade de concentração química que expressa ou relaciona os moles do soluto (n) que estão contidos em um (1) litro (L) da solução.
A molaridade é designada pela letra maiúscula M e para determinar os moles do soluto (n), os gramas do soluto (g) são divididos pelo peso molecular (MW) do soluto..
Da mesma forma, o peso molecular MW do soluto é obtido a partir da soma dos pesos atômicos (PA) ou da massa atômica dos elementos químicos, considerando a proporção em que eles se combinam para formar o soluto. Assim, diferentes solutos têm seus próprios PM (embora nem sempre seja o caso).
Essas definições são resumidas nas seguintes fórmulas que são usadas para realizar os cálculos correspondentes:
Molaridade: M = n (moles de soluto) / V (litro de solução)
Número de moles: n = g de soluto / MW de soluto
Exercício 1
Calcule a molaridade de uma solução que é preparada com 45 g de Ca (OH)dois dissolvido em 250 mL de água.
A primeira coisa a calcular é o peso molecular do Ca (OH)dois (hidróxido de cálcio). De acordo com sua fórmula química, o composto é formado por um cátion cálcio e dois ânions hidroxila. Aqui, o peso de um elétron menor ou adicional à espécie é desprezível, então os pesos atômicos são tomados:
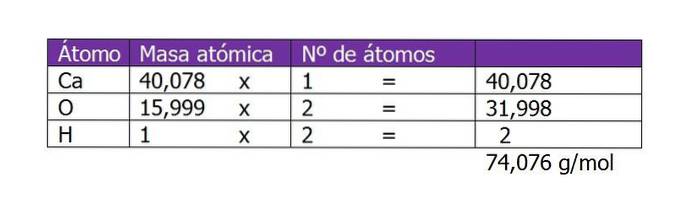
O número de moles do soluto será então:
n = 45 g / (74 g / mol)
n = 0,61 moles de Ca (OH)dois
São obtidos 0,61 moles do soluto, mas é importante lembrar que esses moles estão dissolvidos em 250 mL de solução. Uma vez que a definição de molaridade é moles em um litro ou 1000 mL, uma regra simples de três deve então ser feita para calcular os moles que estão em 1000 mL da referida solução
Se em 250 mL de solução houver => 0,61 moles de soluto
Em 1000 mL de solução => x quantos moles existem?
x = (0,61 mol) (1000 mL) / 250 mL
X = 2,44 M (mol / L)
Outra maneira
A outra forma de obter os moles para aplicar a fórmula exige que os 250 mL sejam levados a litros, aplicando-se também uma regra de três:
Se 1000 ml => são 1 litro
250 ml => x quantos litros são?
x = (250 mL) (1 L) / 1000 mL
x = 0,25 L
Substituindo então na fórmula da molaridade:
M = (0,61 mol de soluto) / (0,25 L de solução)
M = 2,44 mol / L
Exercício 2
O que significa para uma solução de HCl ser 2,5 M?
A solução de HCl é 2,5 molar, ou seja, um litro dela dissolveu 2,5 moles de ácido clorídrico..
Normal
A normalidade ou concentração equivalente, é a unidade de concentração química das soluções que é designada com a letra maiúscula N. Esta unidade de concentração indica a reatividade do soluto e é igual ao número de equivalentes de soluto (Eq) entre o volume da solução expresso em litros.
N = Eq / L
O número de equivalentes (Eq) é igual aos gramas de soluto dividido pelo peso equivalente (PEq).
Eq = g soluto / PEq
O peso equivalente, ou também conhecido como equivalente grama, é calculado obtendo-se o peso molecular do soluto e dividindo-o por um fator equivalente que para efeito de resumo na equação é denominado delta zeta (ΔZ).
PEq = PM / ΔZ
Cálculo
O cálculo da normalidade terá uma variação muito específica no fator equivalente ou ΔZ, que também depende do tipo de reação química da qual o soluto ou espécie reativa participa. Alguns casos dessa variação podem ser citados a seguir:
-Quando se trata de um ácido ou base, ΔZ ou o fator equivalente, será igual ao número de íons de hidrogênio (H+) ou hidroxil OH- que tem o soluto. Por exemplo, ácido sulfúrico (HdoisSW4) tem dois equivalentes porque tem dois prótons ácidos.
-Quando se trata de reações de oxidação-redução, ΔZ corresponderá ao número de elétrons envolvidos no processo de oxidação ou redução, dependendo do caso específico. É aqui que o equilíbrio das equações químicas e a especificação da reação entram em jogo..
-Da mesma forma, este fator equivalente ou ΔZ corresponderá ao número de íons que precipitam nas reações classificadas como precipitação..
Exercício 1
Determine a normalidade de 185 g de NadoisSW4 encontrado em 1,3 L de solução.
O peso molecular do soluto nesta solução será calculado primeiro:
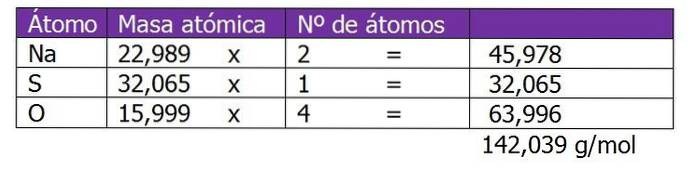
A segunda etapa é calcular o fator equivalente ou ΔZ. Nesse caso, como o sulfato de sódio é um sal, será considerada a valência ou carga do cátion ou Na metálico.+, que será multiplicado por 2, que é o subscrito da fórmula química do sal ou soluto:
N / DdoisSW4 => ∆Z = Valencia Cation x Subscrito
∆Z = 1 x 2
Para obter o peso equivalente, ele é substituído em sua respectiva equação:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / Eq
E então você pode prosseguir para calcular o número de equivalentes, novamente recorrendo a outro cálculo simples:
Eq = (185 g) / (71,02 g / Eq)
Número de equivalentes = 2,605 Eq
Finalmente, com todos os dados necessários, a normalidade agora é calculada substituindo de acordo com sua definição:
N = 2,605 Eq / 1,3 L
N = 2,0 N
Molalidade
Molalidade é designada pela letra minúscula m y é igual aos moles de soluto que estão presentes em um (1) quilograma do solvente. Também é conhecido como concentração molal e é calculado usando a seguinte fórmula:
m = moles de soluto / Kg de solvente
Enquanto a molaridade estabelece a razão dos moles de soluto contidos em um (1) litro da solução, a molalidade relaciona os moles de soluto que existem em um (1) quilograma de solvente.
Nos casos em que a solução é preparada com mais de um solvente, a molalidade expressará os mesmos moles de soluto por quilograma da mistura de solventes..
Exercício 1
Determine a molalidade de uma solução que foi preparada pela mistura de 150 g de sacarose (C12H220onze) com 300 g de água.
O peso molecular da sacarose é primeiro determinado para proceder ao cálculo dos moles de soluto nesta solução:
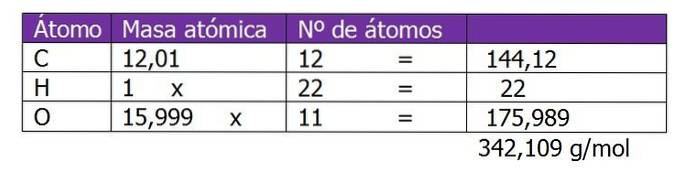
O número de moles de sacarose é calculado:
n = (150g de sacarose) / (342,109 g / mol)
n = 0,438 moles de sacarose
Em seguida, os gramas de solvente são levados a quilogramas para poder aplicar a fórmula final.
Substituindo então:
m = 0,438 moles de sacarose / 0,3 quilogramas de água
m = 1,46 mol C12H220onze/ Kg HdoisOU
Embora atualmente haja um debate sobre a expressão final da molalidade, este resultado também pode ser expresso como:
1,26 m C12H220onze ou 1,26 molal
É por vezes considerado vantajoso expressar a concentração da solução em termos de molalidade, uma vez que as massas do soluto e do solvente não sofrem ligeiras flutuações ou alterações inaparentes devido aos efeitos da temperatura ou pressão; como acontece em soluções com soluto gasoso.
Além disso, ressalta-se que esta unidade de concentração referente a um determinado soluto não é alterada pela existência de outros solutos na solução..
Recomendações e notas importantes sobre concentração química
O volume da solução é sempre maior que o do solvente
À medida que os exercícios de solução são resolvidos, surge o erro de interpretar o volume de uma solução como se fosse o do solvente. Por exemplo, se um grama de chocolate em pó for dissolvido em um litro de água, o volume da solução não será igual ao de um litro de água..
Porque não? Porque o soluto sempre ocupará espaço entre as moléculas do solvente. Quando o solvente tem uma alta afinidade para o soluto, a mudança no volume após a dissolução pode ser insignificante ou insignificante..
Mas, se não, e ainda mais se a quantidade de soluto for grande, a mudança no volume deve ser levada em consideração. Sendo assim: Vsolvent + Vsolute = Vsolution. Apenas em soluções diluídas ou onde as quantidades de soluto são pequenas é válido Vsolvent = Vsolution.
Este erro deve ser levado em consideração, especialmente ao trabalhar com solutos líquidos. Por exemplo, se em vez de dissolver o chocolate em pó, o mel for dissolvido em álcool, o volume de mel adicionado terá efeitos significativos no volume total da solução..
Portanto, nesses casos, o volume do soluto deve ser adicionado ao do solvente..
Utilidade da molaridade
-Conhecer a molaridade de uma solução concentrada permite que cálculos de diluição sejam realizados utilizando a fórmula simples M1V1 = M2V2, onde M1 corresponde à molaridade inicial da solução e M2 a molaridade da solução a ser preparada a partir da solução M1.
-Conhecendo a molaridade de uma solução, sua normalidade pode ser facilmente calculada usando a seguinte fórmula: Normalidade = número de equivalentes x M
As fórmulas não são memorizadas, mas as unidades ou definições são
No entanto, às vezes a memória falha em lembrar todas as equações pertinentes aos cálculos de concentração. Para isso, é muito útil ter uma definição muito clara de cada conceito.
A partir da definição, as unidades são escritas usando o fatores de conversão para expressar aqueles que correspondem ao que você deseja determinar.
Por exemplo, se você tem molalidade e deseja convertê-la para normal, proceda da seguinte forma:
(solvente mol / Kg) x (kg / 1000g) (solvente g / mL) (solvente mL / solução mL) (1000mL / L) (Eq / mol)
Observe que (g solvente / mL) é a densidade do solvente. O termo (mL solvente / mL solução) refere-se a quanto volume da solução realmente corresponde ao solvente. Em muitos exercícios, este último termo é igual a 1, por razões práticas, embora nunca seja totalmente verdadeiro..
Referências
- Química Introdutória - 1st Edição canadense. Unidades quantitativas de concentração. Capítulo 11 Soluções. Retirado de: opentextbc.ca
- Wikipedia. (2018). Concentração equivalente. Retirado de: en.wikipedia.org
- PharmaFactz. (2018). O que é molaridade? Retirado de: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 101-103, 512, 513.
- Soluções aquosas-Molaridade. Retirado de: chem.ucla.edu
- Quimicas.net (2018). Exemplos de normalidade. Recuperado de: quimicas.net.


Ainda sem comentários