
Características dos compostos quaternários, formação, exemplos
O compostos quaternários Eles são todos aqueles que têm quatro átomos ou íons diferentes. Portanto, eles podem ser espécies moleculares ou iônicas. Suas diversidades incluem química orgânica e inorgânica, sendo um grupo muito volumoso; embora talvez não tanto em comparação com compostos binários ou ternários.
A razão de seu número ser menor é porque os quatro átomos ou íons devem ser mantidos juntos por suas afinidades químicas. Nem todos os elementos são compatíveis entre si, e menos ainda quando se considera um quarteto; de repente, um par deles é mais parecido um com o outro do que com o outro par.
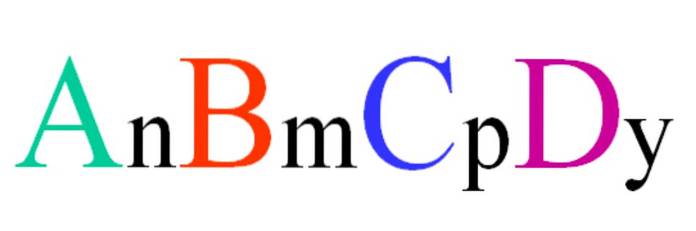
Considere um composto quaternário de fórmula aleatória ABCD. Os subscritos n, m, p e y são os coeficientes estequiométricos, que por sua vez indicam a proporção de cada átomo em relação aos demais..
Assim, a fórmula AnBmCpDY será válido se estiver em conformidade com a eletroneutralidade. Além disso, tal composto será possível se seus quatro átomos estiverem suficientemente relacionados entre si. Será visto que esta fórmula não se aplica a muitos compostos, mas especialmente a ligas ou minerais..
Índice do artigo
- 1 Características dos compostos quaternários
- 1.1 Química
- 1.2 Físico
- 2 Nomenclatura
- 2.1 Oxisales ácidos
- 2.2 Oxisales básicos
- 2.3 Sais duplos
- 2.4 Sais hidratados
- 3 treinamento
- 4 exemplos
- 5 referências
Características dos compostos quaternários
Químico
Um composto quaternário pode ser iônico ou covalente, exibindo as características esperadas para sua natureza. Espera-se que os compostos ABCD iônicos sejam solúveis em água, álcoois ou outros solventes polares; eles devem ter altos pontos de ebulição e fusão, e ser bons condutores de eletricidade quando derretidos.
Em relação aos compostos ABCD covalentes, a maioria é constituída por compostos orgânicos nitrogenados, oxigenados ou halogenados; ou seja, sua fórmula se tornaria CnHmOUpNY ou CnHmOUpXY, onde X é um átomo de halogênio. Dessas moléculas, seria lógico pensar que eram polares, dadas as altas eletronegatividades de O, N e X.
Um composto ABCD puramente covalente pode ter muitas possibilidades de ligação: A-B, B-C, D-A, etc., obviamente dependendo das afinidades e capacidades eletrônicas dos átomos. Considerando que em um composto ABCD puramente iônico, suas interações são eletrostáticas: A+B-C+D-, por exemplo.
No caso de uma liga, considerada mais uma mistura sólida do que um composto propriamente dito, o ABCD consiste em átomos neutros em estado fundamental (em teoria).
Do resto, um composto ABCD pode ser neutro, ácido ou básico, dependendo da identidade de seus átomos..
Fisica
Fisicamente falando, é provável que o ABCD não se torne um gás, já que quatro átomos diferentes sempre implicam em uma massa molecular ou fórmula mais alta. Se não for um líquido com alto ponto de ebulição, é de se esperar que seja um sólido, cuja decomposição deve gerar muitos produtos.
Novamente, suas cores, cheiro, textura, cristais, etc., estarão sujeitos à forma como A, B, C e D coexistem no composto e dependerão de sua sinergia e estruturas..
Nomenclatura
Até o momento, a questão dos compostos quaternários tem sido abordada de forma global e imprecisa. Deixando de lado a química orgânica (amidas, cloretos de benzila, sais de amônio quaternário, etc.), na química inorgânica existem exemplos bem definidos chamados oxisaltos ácidos e básicos..
Oxisales de ácido
Os oxisaltos ácidos são aqueles que derivam da neutralização parcial de um oxoácido poliprótico. Assim, um ou mais de seus hidrogênios são substituídos por cátions metálicos, e quanto menos hidrogênios restantes ele tiver, menos ácido será..
Por exemplo, a partir de ácido fosfórico, H3PO4, Podem ser obtidos até dois sais de ácido de, digamos, sódio. São eles: NaHdoisPO4 (N / D+ substitui um hidrogênio equivalente a H+) e NadoisHPO4.
De acordo com a nomenclatura tradicional, esses sais são nomeados da mesma forma que os oxisaltos (totalmente desprotonados), mas com a palavra 'ácido' precedendo o nome do metal. Assim, o NaHdoisPO4 seria fosfato diácido de sódio, e NadoisHPO4 fosfato de ácido de sódio (porque ainda tem um H).
Por outro lado, a nomenclatura de estoque prefere usar a palavra 'hidrogênio' do que 'ácido'. O NaHdoisPO4 se tornaria dihidrogenofosfato de sódio, e NadoisHPO4 hidrogenofosfato de sódio. Observe que esses sais têm quatro átomos: Na, H, P e O.
Oxisales básicos
Os oxisaltos básicos são aqueles que contêm o ânion OH em sua composição-. Por exemplo, considere o sal CaNO3OH (Cadois+ NÃO3- Oh-) Para nomeá-lo, bastaria preceder a palavra 'básico' ao nome do metal. Assim, seu nome seria: nitrato de cálcio básico. E quanto ao CuIO3OH? Seu nome seria: iodato cúprico básico (Cudois+ IO3- Oh-).
De acordo com a nomenclatura de estoque, a palavra 'básico' é substituída por hidróxido, seguida do uso de um hífen antes do nome do oxoanion..
Repetindo os exemplos anteriores, seus nomes seriam para cada um: Hidróxido-nitrato de cálcio e hidróxido-iodato de cobre (II); lembrando que a valência do metal deve ser indicada entre parênteses e com algarismos romanos.
Sais duplos
Em sais duplos, existem dois cátions diferentes interagindo com o mesmo tipo de ânion. Suponha que o sal duplo: Cu3Faith (PO4)3 (Cudois+ Fé3+ PO43-) É um fosfato de ferro e cobre, mas o nome mais adequado para se referir a isso é: fosfato triplo de cobre (II) e ferro (III).
Sais hidratados
São hidratos, e a única diferença é que a quantidade de água a formular é especificada no final de seus nomes. Por exemplo, o MnCldois é cloreto de manganês (II).
Seu hidrato, MnCldois4hdoisOu é chamado de tetra-hidrato de cloreto de manganês (II). Observe que existem quatro átomos diferentes: Mn, Cl, H e O.
Um famoso sal duplo hidratado é Mohr's, Fe (NH4)dois(SW4)dois6hdoisO. Seu nome é: sulfato de ferro duplo (II) e hexahidrato de amônio.
Treinamento
Novamente, focalizando os compostos quaternários inorgânicos, parece que eles são principalmente o produto de neutralizações parciais. Se estes ocorrerem na presença de vários óxidos de metal, é provável que surjam sais duplos; e se o meio for muito básico, os oxisaltos básicos precipitarão.
E se, por outro lado, as moléculas de água têm afinidade com o metal, elas se coordenarão diretamente com ele ou com os íons que o cercam, formando os hidratos..
No lado da liga, quatro metais ou metalóides diferentes devem ser soldados para fazer capacitores, semicondutores ou transistores..
Exemplos
Finalmente, uma lista com diferentes exemplos de compostos quaternários é mostrada abaixo. O leitor pode usá-lo para testar seus conhecimentos de nomenclatura:
- PbCO3(OH)dois
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- Cudois(OH)doisSW3
- LidoisKAsO4
- CURSO45hdoisOU
- AgAu (SO4)dois
- Caso42hdoisOU
- FeCl36hdoisOU
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Nomenclatura e formulação inorgânica. [PDF]. Recuperado de: recursostic.educacion.es
- Erika Thalîa, bom. (2019). Sais duplos. Academia. Recuperado de: academia.edu
- Wikipedia. (2019). Catião amônio quaternário. Recuperado de: en.wikipedia.org


Ainda sem comentários