
Estrutura, propriedades, usos do cloreto de sódio (NaCl)
O cloreto de sódio, Também chamado de sal comum ou sal de mesa, é um sal inorgânico binário do sódio de metal alcalino e do cloro halógeno. É o maior componente do sal comestível e sua forma mineral é conhecida como halita. Sua fórmula molecular é NaCl, e descreve a razão estequiométrica de seus íons (Na+ Cl-) e não de uma molécula discreta (Na-Cl)
O cloreto de sódio é um sólido cristalino branco formado pela combinação do sódio, um metal branco prateado, que reage violentamente com a água, e do elemento cloro, um gás venenoso, corrosivo e verde pálido..

Uma parte dos cristais de NaCl é mostrada na imagem superior. Como é possível que dois elementos tão perigosos como Na e Cldois, um sal comestível pode ser formado? Primeiro, a equação química para sua formação é:
2Na (s) + Cldois(g) => 2NaCl (s)
A resposta está na natureza da ligação em NaCl. Por ser iônico, as propriedades do Na+ e Cl- são diagonalmente diferentes de seus átomos neutros.
O sódio é um elemento vital, mas em sua forma iônica. Então uma+ é o principal cátion extracelular com uma concentração de aproximadamente 140 mEq / l, e junto com seus ânions companheiros, Cl- e o HCO3- (bicarbonato), são os principais responsáveis pelo valor da osmolaridade e do volume extracelular.
Além disso, o Na+ é responsável pela geração e condução do impulso nervoso nos axônios neuronais, bem como por iniciar a contração muscular.
O NaCl tem sido usado desde os tempos antigos para dar sabor aos alimentos e preservar a carne, devido à sua capacidade de matar bactérias e prevenir a deterioração.
Também é necessário para a produção de hidróxido de sódio (NaOH) e cloro molecular (Cldois), reagindo NaCl com água sob hidrólise:
2hdoisO (l) + 2 NaCl (s) => 2NaOH (aq) + Cldois(g) + Hdois(g)
No cátodo (-) acumula o Hdois (g) e NaOH. Enquanto isso, no ânodo (+) o Cl se acumuladois (g). O hidróxido de sódio é utilizado na fabricação de sabões e cloro na fabricação de plástico PVC.
Índice do artigo
- 1 Estrutura do cloreto de sódio
- 1.1 Célula unitária
- 2 propriedades
- 2.1 Fórmula molecular
- 2.2 Peso molecular
- 2.3 Descrição física
- 2.4 Cor
- 2,5 Sabor
- 2.6 Ponto de ebulição
- 2.7 Ponto de fusão
- 2.8 Solubilidade em água
- 2.9 Solubilidade em solventes orgânicos
- 2.10 Densidade
- 2.11 Pressão de vapor
- 2.12 Estabilidade
- 2.13 Decomposição
- 2,14 Viscosidade
- 2,15 Corrosão
- 2,16 pH
- 3 usos
- 3.1 Em alimentos
- 3.2 Usos industriais
- 3.3 Em casa
- 3.4 Outros usos
- 3.5 Usos terapêuticos
- 4 Toxicidade
- 4.1 Ingestão
- 4.2 Irritação e contato físico
- 5 referências
Estrutura do cloreto de sódio
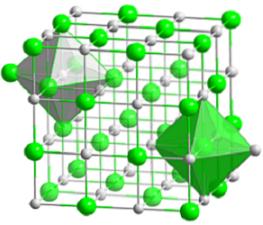
A imagem superior representa a estrutura cúbica compacta do cloreto de sódio. As volumosas esferas verdes correspondem aos ânions Cl-, enquanto os brancos, para os Na cations+. Observe como o cristal de NaCl consiste em uma rede de íons organizados por suas interações eletrostáticas em uma proporção de 1: 1..
Embora as barras sejam mostradas na imagem, as ligações não são covalentes, mas iônicas. O uso de barras é útil ao mostrar a geometria de coordenação em torno de um íon. Por exemplo, no caso de NaCl cada Na+ é cercado por seis Cl- (octaedro branco), e cada Cl- de seis Na+ (octaedro verde).
Portanto, possui uma coordenação (6,6) cujos números indicam quantos vizinhos circundam cada íon. O número à direita indica os vizinhos do Na+, enquanto o da esquerda, os do Cl-.
Outras representações omitem o uso de barras para destacar os orifícios octaédricos na estrutura, que resultam do espaço intersticial entre seis ânions Cl.- (ou Na cations+) embalado. Este arranjo é observado em outros sais inorgânicos mono (MX) ou poliatômicos, e é chamado de sal gema.
Célula unitária
A célula unitária do sal-gema é cúbica, mas quais cubos a representam exatamente na imagem acima? Os octaedros dão a resposta. Ambos cobrem uma célula total composta por quatro pequenos cubos.
Esses cubos têm porções dos íons em seus vértices, arestas e faces. Olhando de perto, um Naion+ ele está localizado no centro e doze deles nas bordas. Um íon em uma borda pode ser compartilhado por quatro cubos. Portanto, existem 4 íons de Na+ (12 × 1/4 + 1 = 4).
Para íons Cl-, oito estão localizados nos vértices e seis nas bordas. Como os íons posicionados nos vértices compartilham espaço com outros oito cubos, e nas bordas com seis, temos 4 íons Cl- (8 × 1/8 + 6 × 1/2 = 4).
O resultado acima é interpretado da seguinte forma: na célula unitária de NaCl existem quatro cátions Na+ e quatro ânions Cl-; proporção que concorda com a fórmula química (um Na+ para cada Cl-).
Propriedades
Fórmula molecular
NaCl.
Peso molecular
58,44 g / mol.
Descrição física
Um sólido cristalino.
Cor
Cristais transparentes incolores ou pó cristalino branco.
Gosto
Salgado.
Ponto de ebulição
2.575ºF a 760 mmHg.
1.465 ºC.
Ponto de fusão
1.474 ºF (800,7 ºC).
Tanto o ponto de ebulição quanto o ponto de fusão refletem o calor necessário para superar a energia da rede cristalina. Portanto, essas medições confirmam o caráter iônico do NaCl..
Solubilidade em água
Maior ou igual a 100 mg / ml a 68ºF.
36,0 g / 100 ml a 25 ° C.
Na verdade, é um sal higroscópico, que retém a umidade do meio ambiente.
Solubilidade em solventes orgânicos
0,065 g / 100 mL de etanol a 25 ° C; 10 g / 100 g de glicerol a 25 ° C; 2,15 g / 100 mL de amônia líquida a 40 ° C; 1,4 g / 100 mL de metanol a 25 ° C; 7,15 g / 100 de etilenoglicol a 25 ° C e 5,21 g / 100 g de ácido fórmico a 25 ° C.
Densidade
2,165 g / cm3 a 77 ºC.
Pressão de vapor
1 mmHg a 1.589ºF.
Estabilidade
Estável sob as condições de armazenamento recomendadas.
Decomposição
Quando aquecido a altas temperaturas, ele se decompõe, emitindo vapores de ácido clorídrico e óxido dissódico..
Viscosidade
Viscosidade de soluções saturadas 1,93 mPa-s.
Corrosão
É corrosivo para muitos metais.
pH
6,7 a 7,3 em solução aquosa.
Formulários
Na comida
-O cloreto de sódio é usado desde a antiguidade para melhorar o sabor dos alimentos e preservá-los. Salgar a carne é uma forma de preservá-la da ação bacteriana, pois retarda a quebra de proteínas.
-Por outro lado, o sal aumenta a osmolaridade ao redor da carne, o que provoca a absorção por osmose da água da bactéria, causando sua eliminação.
Usos industriais
Indústria de alimentos
-Na indústria de alimentos, o sal é usado como intensificador de sabor, aditivo de controle de fermentação, agente de controle de textura e revelador de cor. Por exemplo, o sal é adicionado para realçar a cor do bacon, presunto e outros produtos à base de carne..
-O sal serve como aglutinante na preparação de salsichas. Contribui para a formação de um gel aglutinante composto por carne, gordura e umidade.
-No processamento de farinha para fazer pão, o sal é adicionado durante o cozimento para controlar a taxa de fermentação da massa de pão. Também é utilizado para fortalecer o glúten e como intensificador de sabor, além de recheio de assados.
-É utilizado na fabricação de cereais matinais, farinhas misturadas ou preparadas, batatas fritas, alimentos para cães e gatos, etc..
Síntese de produtos químicos
-O cloreto de sódio é utilizado como matéria-prima na produção de hidróxido de sódio e cloro, os quais, por sua vez, são úteis em muitas indústrias químicas.
-O sal é usado no processamento de vários metais, por exemplo, alumínio, cobre, aço e vanádio. Ele também é usado para fazer clorato de sódio, que mais tarde é usado na síntese de dióxido de cloro, um alvejante à base de oxigênio. O dióxido de cloro é menos prejudicial ao meio ambiente do que outros alvejantes.
Na industria do couro
-O sal é utilizado para inibir a ação bacteriana no interior da pele, além de auxiliar na sua reidratação.
Na industria textil
-O sal é usado como mordente no tingimento de tecidos. É usado como um enxágue de salmoura para remover contaminantes orgânicos e para criar uma carga positiva na superfície dos tecidos que permite a ligação de corantes carregados negativamente.
Na industria do petroleo
-Na exploração de petróleo e gás, o sal é um componente importante dos fluidos de perfuração de poços. É utilizado para flocular e aumentar a densidade dos líquidos de perfuração, o que permite superar as altas pressões do gás nos poços a serem atingidas. Além disso, o sal mantém a saturação do líquido de perfuração.
-O sal ajuda a compactar o solo sobre o qual as estradas são construídas. Reduz o deslocamento subterrâneo causado por mudanças de umidade e tráfego automotivo.
No lar
O sal tem sido usado para esfregar na limpeza de superfícies, potes e frigideiras. Também na prevenção de bolor e como tira nódoas. Também é usado em muitas marcas de xampu e pasta de dente..
Outros usos
Nas estradas
-Antecipando-se à queda de neve, as estradas são cobertas com salmoura, o que evita que o gelo se fixe na superfície da estrada. Para o descongelamento, é usada uma mistura de salmoura e sal e, às vezes, outros componentes químicos, como cloreto de magnésio ou cálcio, são adicionados. O uso de sal e salmoura não é eficaz em temperaturas abaixo de -10 ºC.
A adição de sal produz uma diminuição do ponto crioscópico, propriedade coligativa das soluções, dificultando de certa forma a formação de gelo..
-Devido à sua condição higroscópica, o sal é usado como um dessecante barato.
Em resinas usadas para amaciar água
A água dura contém íons cálcio e magnésio que dificultam a ação do sabão e causam depósitos de materiais alcalinos em vários equipamentos e tubulações. No amaciamento de água, são utilizadas resinas de troca iônica. O sal é utilizado na preparação e regeneração de resinas.
Em extintores de incêndio
O cloreto de sódio é usado em extintores de incêndio para combater incêndios nos quais estão presentes metais combustíveis, como magnésio, potássio, sódio e ligas NK..
O sal atua como dissipador de calor e também forma uma crosta que restringe o acesso do oxigênio ao fogo..
Nos copos
Cristais de cloreto de sódio são usados em componentes ópticos como janelas e prismas, especialmente para luz infravermelha. Porém, como o sal é muito higroscópico, produz-se uma espécie de gelo que cobre as lentes. Por esse motivo, as lentes de cloreto de sódio foram substituídas por lentes de seleneto de zinco (ZnSe)..
Usos terapêuticos
Compensar a falta de sais no corpo
-Quando há uma depleção corporal de Na+, deve ser substituído para manter a osmolaridade extracelular, condução nervosa e contração muscular.
-O NaCl é utilizado no tratamento e prevenção da deficiência de sódio e cloro, decorrentes da sudorese excessiva durante a exposição a altas temperaturas. Também é usado em uma diurese excessiva ou uma restrição excessiva da ingestão de solução salina.
-A administração parenteral de uma solução de NaCl a 045% é usada no tratamento do diabetes hiperosmolar. Ele cumpre a função de reidratação e serve para avaliar o estado da função renal.
-Injeções de soluções hipertônicas, com concentração de NaCl superior a 0,9% p / v,
-Eles são usados quando há uma grave depleção de Na+, sendo uma restauração do íon essencial. Essa hiponatremia pode ser consequência de um tratamento com eletrólitos livres ou com concentração de Na+.
A hiponatremia também pode ser causada por ingestão excessiva de água, não controlada por função renal inadequada..
Em tratamentos e usos não convencionais
-As soluções para inalação de NaCl são usadas para diluir os medicamentos usados durante o processo de nebulização. Também é usado para lavagem e irrigação traqueal. Solução salina a 0,9% usada em sprays nasais.
-Soluções de NaCl a 20% são usadas para instalação transabdominal intra-amniótica, induzindo assim um aborto tardio durante o segundo trimestre da gravidez..
-O cloreto de sódio pode ser usado como um anti-séptico local. Graças à sua capacidade osmótica, é capaz de desidratar um amplo espectro de vírus e bactérias em um estado não-espalhado; portanto, é usado como um anti-séptico doloroso para desinfetar feridas.
Toxicidade
Ingestão
Só tem efeito nocivo para a saúde se a ingestão for elevada e por muito tempo. Nessas circunstâncias, ocorreria hipernatremia com conseqüente aumento do volume extracelular que levaria à hipertensão arterial..
Irritação e contato físico
Tem efeito tóxico apenas se a inalação for muito elevada. O contato excessivo com a pele pode causar ressecamento. Finalmente, causa uma irritação momentânea no contato com os olhos.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição, páginas 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning, p 482-483.
- Cloreto de sódio. (2018). Cloreto de sódio: benefícios, usos, propriedades, riscos. Retirado de: cloreto de sódio.org
- PubChem. (2018). Cloreto de Sódio. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Cloreto de Sódio. Retirado de: en.wikipedia.org
- Elementos americanos. (2018). Cloreto de Sódio. Retirado de: americanelements.com



Ainda sem comentários