
História do cloro, propriedades, estrutura, riscos, usos
O cloro É um elemento químico representado pelo símbolo Cl, é o segundo dos halogênios, localizado abaixo do flúor, e é também o terceiro elemento mais eletronegativo de todos. Seu nome deriva de sua cor verde amarelada, mais intensa que o flúor..
Popularmente, quando alguém ouve seu nome, a primeira coisa que pensa é nos produtos de branqueamento de roupas e na água das piscinas. Embora o cloro funcione efetivamente em tais exemplos, não é seu gás, mas seus compostos (especialmente o hipoclorito) que exercem a ação branqueadora e desinfetante..

A imagem acima mostra um frasco redondo com gás cloro. Sua densidade é maior que a do ar, o que explica por que permanece no frasco e não escapa para a atmosfera; como acontece com outros gases mais leves, como hélio ou nitrogênio. Nesse estado, é uma substância altamente tóxica, pois produz ácido clorídrico nos pulmões..
É por isso que o cloro elementar ou gasoso não tem muitos usos, a não ser em algumas sínteses. Porém, seus compostos, sejam eles sais ou moléculas orgânicas cloradas, cobrem um bom repertório de utilizações, indo além de piscinas e roupas extremamente brancas..
Da mesma forma, seus átomos na forma de ânions cloreto são encontrados em nosso corpo, regulando os níveis de sódio, cálcio e potássio, bem como no suco gástrico. Caso contrário, a ingestão de cloreto de sódio seria ainda mais letal.
O cloro é produzido pela eletrólise da salmoura, rica em cloreto de sódio, processo industrial no qual também se obtém o hidróxido de sódio e o hidrogênio. E como os mares são uma fonte quase inesgotável desse sal, as reservas potenciais desse elemento na hidrosfera são muito grandes..
Índice do artigo
- 1 história
- 1.1 Primeiras abordagens
- 1.2 Descoberta
- 1.3 Ácido oximurático
- 1.4 Reconhecimento como um elemento
- 2 Propriedades físicas e químicas
- 2.1 Aparência física
- 2.2 Número atômico (Z)
- 2.3 Peso atômico
- 2.4 Ponto de ebulição
- 2.5 Ponto de fusão
- 2.6 Densidade
- 2.7 Calor de fusão
- 2.8 Calor de vaporização
- 2,9 capacidade de calor molar
- 2.10 Solubilidade em água
- 2.11 Pressão de vapor
- 2.12 Eletronegatividade
- 2.13 Energias de ionização
- 2.14 Condutividade térmica
- 2,15 Isótopos
- 2,16 números de oxidação
- 3 Estrutura e configuração eletrônica
- 3.1 Molécula de cloro
- 3.2 Interações intermoleculares
- 4 Onde encontrar e obter
- 4.1 Sais de cloreto
- 4.2 Eletrólise de salmoura
- 4.3 Dissolução ácida da pirolusita
- 5 ligas
- 6 riscos
- 7 usos
- 7.1 Síntese
- 7.2 Biológicos
- 7.3 Armas químicas
- 7.4 Desinfetante
- 7,5 lixívia
- 7,6 policloreto de vinila
- 8 referências
História
Primeiras abordagens
Devido à alta reatividade do gás cloro, as civilizações antigas nunca suspeitaram de sua existência. No entanto, seus compostos faziam parte da cultura da humanidade desde os tempos antigos; sua história começou ligada ao sal comum.
Por outro lado, o cloro surgiu de erupções vulcânicas e quando alguém dissolveu o ouro na água régia; Mas nenhuma dessas primeiras abordagens foi suficiente para formular a ideia de que o referido gás verde-amarelado era um elemento ou composto.
Descoberta
A descoberta do cloro é atribuída ao químico sueco Carl Wilhelm Scheele, que em 1774 realizou a reação entre o mineral pirolusita e o ácido clorídrico (então chamado de ácido muriático).
Scheele recebe o crédito por ter sido o primeiro cientista a estudar as propriedades do cloro; embora previamente reconhecido (1630) por Jan Baptist van Helmont.
Os experimentos com os quais Scheele obteve suas observações são interessantes: ele avaliou a ação branqueadora do cloro nas pétalas avermelhadas e azuladas das flores, bem como nas folhas de plantas e insetos que morriam instantaneamente..
Da mesma forma, ele relatou sua alta reatividade para metais, seu cheiro sufocante e efeito indesejável nos pulmões, e que quando dissolvido em água, sua acidez aumentava..
Ácido oximurático
A essa altura, os químicos consideravam qualquer composto que contivesse oxigênio um ácido; então eles pensaram erroneamente que o cloro deve ser um óxido gasoso. É assim que o chamam de 'ácido oximurático' (óxido de ácido muriático), um nome cunhado pelo famoso químico francês Antoine Lavoisier.
Então, em 1809, Joseph Louis Gay-Lussac e Louis Jacques Thénard tentaram reduzir esse ácido com carvão; reação com a qual eles obtiveram metais de seus óxidos. Dessa forma, eles queriam extrair o elemento químico do suposto ácido oximurático (que eles chamaram de 'ar desmatado com ácido muriático'.
No entanto, Gay-Lussac e Thénard falharam em seus experimentos; mas eles estavam certos ao considerar a possibilidade de que o referido gás verde-amarelado deve ser um elemento químico e não um composto.
Reconhecimento como elemento
O reconhecimento do cloro como elemento químico foi graças a Sir Humphry Davy, que em 1810 realizou seus próprios experimentos com eletrodos de carbono e concluiu que tal óxido de ácido muriático não existia..
E, além disso, foi Davy quem cunhou o nome 'cloro' para este elemento da palavra grega 'chloros', que significa verde amarelado..
À medida que estudavam as propriedades químicas do cloro, muitos de seus compostos eram de natureza salina; daí eles o chamaram de 'halogênio', que significa formador de sal. Em seguida, o termo halogênio foi usado com os outros elementos de seu mesmo grupo (F, Br e I).
Michael Faraday conseguiu até liquefazer o cloro em um sólido que, por estar contaminado com água, formou o hidrato CldoisHdoisOU.
O resto da história do cloro está ligado às suas propriedades desinfetantes e branqueadoras, até o desenvolvimento do processo industrial de eletrólise da salmoura para a produção de grandes quantidades de cloro..
Propriedades físicas e químicas
Aparência física
É um gás denso, opaco, verde-amarelado, com um odor acre irritante (uma versão super aprimorada do cloro comercial) e também é extremamente venenoso..
Número atômico (Z)
17
Peso atômico
35,45 u.
Salvo indicação em contrário, todas as outras propriedades correspondem às quantidades medidas para cloro molecular, Cldois.
Ponto de ebulição
-34,04 ºC
Ponto de fusão
-101,5 ºC
Densidade
-Em condições normais, 3,2 g / L
-Bem no ponto de ebulição, 1,5624 g / mL
Observe que o cloro líquido é aproximadamente cinco vezes mais denso que seu gás. Além disso, a densidade de seu vapor é 2,49 vezes maior do que a do ar. É por isso que na primeira imagem o cloro não tende a escapar do frasco redondo, pois por ser mais denso que o ar está localizado na parte inferior. Essa característica o torna um gás ainda mais perigoso..
Calor de fusão
6,406 kJ / mol
Calor da vaporização
20,41 kJ / mol
Capacidade de calor molar
33,95 J / (mol K)
Solubilidade em água
1,46 g / 100 mL a 0 ºC
Pressão de vapor
7,67 atm a 25 ° C Esta pressão é relativamente baixa em comparação com outros gases.
Eletro-negatividade
3,16 na escala de Pauling.
Energias de ionização
-Primeiro: 1251,2 kJ / mol
-Segundo: 2298 kJ / mol
-Terceiro: 3822 kJ / mol
Condutividade térmica
8,9 10-3 W / (mK)
Isótopos
O cloro ocorre na natureza principalmente como dois isótopos: 35Cl, com abundância de 76%, e 37Cl, com abundância de 24%. Assim, o peso atômico (35,45 u) é uma média das massas atômicas desses dois isótopos, com seus respectivos percentuais de abundância..
Todos os radioisótopos do cloro são artificiais, entre os quais o 36Cl como o mais estável, com meia-vida de 300.000 anos.
Números de oxidação
O cloro pode ter vários números ou estados de oxidação quando faz parte de um composto. Por ser um dos átomos mais eletronegativos da tabela periódica, geralmente apresenta números de oxidação negativos; exceto quando se depara com oxigênio ou flúor, em cujos óxidos e fluoretos, respectivamente, tem que "perder" elétrons.
Em seus números de oxidação, a existência ou presença de íons com a mesma magnitude de carga é assumida. Assim, temos: -1 (Cl-, o famoso ânion cloreto), +1 (Cl+), +2 (Cldois+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) e +7 (Cl7+) De todos eles, -1, +1, +3, +5 e +7 são os mais comuns encontrados em compostos clorados..
Por exemplo, em ClF e ClF3 os números de oxidação para cloro são +1 (Cl+F-) e +3 (Cl3+F3-) No CldoisOu, este é +1 (Cldois+OUdois-); enquanto no ClOdois, CldoisOU3 e CldoisOU7, são +4 (Cl4+OUdoisdois-), +3 (Cldois3+OU3dois-) e +7 (Cldois7+OU7dois-).
Em todos os cloretos, por outro lado, o cloro tem um número de oxidação de -1; como no caso de NaCl (Na+Cl-), onde é válido dizer que o Cl existe- dada a natureza iônica deste sal.
Estrutura e configuração eletrônica
Molécula de cloro

Os átomos de cloro em seu estado fundamental têm a seguinte configuração eletrônica:
[Ne] 3sdois 3p5
Portanto, cada um deles tem sete elétrons de valência. A menos que estejam sobrecarregados de energia, haverá átomos de Cl individuais no espaço, como bolas de gude verdes. No entanto, sua tendência natural é formar ligações covalentes entre eles, a fim de completar seus octetos de valência..
Observe que eles dificilmente precisam de um elétron para ter oito elétrons de valência, então eles formam uma única ligação simples; isto é, aquele que une dois átomos de Cl para criar a molécula de Cldois (imagem superior), Cl-Cl. É por isso que o cloro em condições normais e / ou terrestres é um gás molecular; não monoatômico, como com gases nobres.
Interações intermoleculares
A molécula Cldois é homonuclear e apolar, portanto suas interações intermoleculares são governadas pelas forças de dispersão de London e suas massas moleculares. Na fase gasosa, a distância Cldois-Cldois é relativamente curto em comparação com outros gases que, somados à sua massa, o tornam um gás três vezes mais denso que o ar.
A luz pode excitar e promover transições eletrônicas dentro dos orbitais moleculares de Cldois; conseqüentemente, aparece sua cor verde-amarelada característica. Esta cor se intensifica no estado líquido e, em seguida, desaparece parcialmente quando se solidifica.
Conforme a temperatura cai (-34 ºC), as moléculas de Cldois perder energia cinética e distância Cldois-Cldois diminui; portanto, estes coalescem e acabam definindo o cloro líquido. O mesmo acontece quando o sistema é resfriado ainda mais (-101 ºC), agora com as moléculas de Cldois tão próximos que definem um cristal ortorrômbico.
O fato de existirem cristais de cloro é indicativo de que suas forças dispersivas são direcionais o suficiente para criar um padrão estrutural; isto é, camadas moleculares de Cldois. A separação dessas camadas é tal que sua estrutura não muda mesmo sob uma pressão de 64 GPa, nem exibem condução elétrica..
Onde encontrar e obter
Sais de cloreto

O cloro em seu estado gasoso não pode ser encontrado em nenhum lugar da superfície terrestre, pois é muito reativo e tende a formar cloretos. Esses cloretos estão bem difundidos por toda a crosta terrestre e, além disso, após milhões de anos sendo arrastados pelas chuvas, estão enriquecendo os mares e oceanos..
De todos os cloretos, o NaCl do mineral halita (imagem superior) é o mais comum e abundante; seguido pelos minerais silvin, KCl, e carnalita, MgCldoisKCl 6HdoisO. Quando as massas de água evaporam devido à ação do Sol, elas deixam para trás lagos de sal do deserto, dos quais o NaCl pode ser extraído diretamente como matéria-prima para a produção de cloro..
Eletrólise de salmoura
O NaCl se dissolve em água para produzir uma salmoura (26%), que é submetida à eletrólise dentro de uma célula de cloro-álcali. Lá, duas semi-reações ocorrem nos compartimentos anódico e catódico:
2Cl-(ac) => Cldois(g) + 2e- (Ânodo)
2hdoisO (l) + 2e- => 2OH-(ac) + Hdois(g) (cátodo)
E a equação global para ambas as reações é:
2NaCl (aq) + 2HdoisO (l) => 2NaOH (aq) + Hdois(g) + Cldois(g)
Conforme a reação prossegue, os íons Na+ formados no ânodo migram para o compartimento do cátodo através de uma membrana de amianto permeável. Por esse motivo, o NaOH está do lado direito da equação global. Ambos os gases, Cldois e Hdois, são coletados do ânodo e cátodo, respectivamente.
A imagem abaixo ilustra o que acabou de ser escrito:
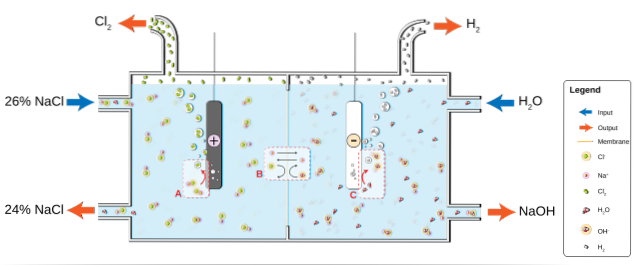
Observe que a concentração da salmoura no final diminui em 2% (vai de 24 a 26%), o que significa que parte de seus ânions Cl- originais foram transformados em moléculas de Cldois. No final das contas, a industrialização desse processo deu um método para a produção de cloro, hidrogênio e hidróxido de sódio..
Dissolução ácida da pirolusita
Conforme mencionado na seção de história, o cloro gasoso pode ser produzido dissolvendo amostras de minerais de pirolusita com ácido clorídrico. A seguinte equação química mostra os produtos obtidos a partir da reação:
MnOdois(s) + 4HCl (aq) => MnCldois(aq) + 2HdoisO (l) + Cldois(g)
Ligas
As ligas de cloro não existem por dois motivos simples: suas moléculas gasosas não podem ser aprisionadas entre cristais metálicos e também são muito reativas, de modo que reagiriam imediatamente com os metais para produzir seus respectivos cloretos..
Por outro lado, os cloretos também não são desejáveis, pois uma vez dissolvidos na água exercem um efeito salino que promove a corrosão das ligas; e, portanto, os metais se dissolvem para formar cloretos de metal. O processo de corrosão para cada liga é diferente; alguns são mais suscetíveis do que outros.
O cloro, portanto, não é um bom aditivo para ligas; nem como Cldois nem como Cl- (e átomos de Cl seriam muito reativos, então eles podem até existir).
Riscos
Embora a solubilidade do cloro na água seja baixa, é o suficiente para produzir ácido clorídrico na umidade da pele e dos olhos, que acaba corroendo os tecidos causando sérias irritações e até perda de visão..
Pior ainda é respirar seus vapores amarelo-esverdeados, pois uma vez nos pulmões volta a gerar ácidos e danifica o tecido pulmonar. Com isso, a pessoa sente dor de garganta, tosse e dificuldades respiratórias devido aos fluidos formados nos pulmões.
Se houver um vazamento de cloro, você está em uma situação particularmente perigosa: o ar não pode simplesmente "varrer" seus vapores; eles ficam lá até que reajam ou se dispersem lentamente.
Além disso, é um composto altamente oxidante, de modo que várias substâncias podem reagir explosivamente com ele ao menor contato; assim como lã de aço e alumínio. Por isso, onde houver cloro armazenado, todas as considerações necessárias devem ser tomadas para evitar os riscos de incêndio..
Ironicamente, embora o cloro gasoso seja mortal, seu ânion cloreto não é tóxico; Pode ser consumido (com moderação), não queima, nem reage exceto com flúor e outros reagentes.
Formulários
Síntese
Cerca de 81% do gás cloro produzido anualmente é usado para a síntese de cloretos orgânicos e inorgânicos. Dependendo do grau de covalência desses compostos, o cloro pode ser encontrado como meros átomos de Cl em moléculas orgânicas cloradas (com ligações C-Cl), ou como íons de Cl- em alguns sais de cloreto (NaCl, CaCldois, MgCldois, etc.).
Cada um desses compostos tem suas próprias aplicações. Por exemplo, clorofórmio (CHCl3) e cloreto de etila (CH3CHdoisCl) são solventes que passaram a ser usados como anestésicos inalatórios; diclorometano (CHdoisCldois) e tetracloreto de carbono (CCl4), entretanto, são solventes amplamente utilizados em laboratórios de química orgânica.
Quando esses compostos clorados são líquidos, na maioria das vezes são usados como solventes para meios de reação orgânicos..
Em outros compostos, a presença de átomos de cloro representa um aumento no momento de dipolo, de forma que eles podem interagir em maior grau com uma matriz polar; um composto de proteínas, aminoácidos, ácidos nucléicos, etc., biomoléculas. Assim, o cloro também desempenha um papel na síntese de medicamentos, pesticidas, inseticidas, fungicidas, etc..
Em relação aos cloretos inorgânicos, eles costumam ser utilizados como catalisadores, matéria-prima para a obtenção de metais por eletrólise, ou fontes de íons Cl.-.
Biológico
O cloro gasoso ou elementar não tem função nos seres vivos, a não ser destruir seus tecidos. No entanto, isso não significa que seus átomos não possam ser encontrados no corpo. Por exemplo, íons Cl- são muito abundantes no ambiente celular e extracelular, e ajudam a controlar os níveis de íons Na+ e Cadois+, em sua maioria.
Da mesma forma, o ácido clorídrico faz parte do suco gástrico com o qual o alimento é digerido no estômago; seus Cl ions-, na companhia de H3OU+, definir o pH próximo a 1 dessas secreções.
Armas quimicas
A densidade do gás cloro o torna uma substância mortal quando derramado ou derramado em espaços fechados ou abertos. Por ser mais denso que o ar, uma corrente dele não transporta cloro facilmente, então permanece por um tempo considerável antes de finalmente se dispersar.
Na Primeira Guerra Mundial, por exemplo, esse cloro foi usado em campos de batalha. Uma vez liberado, ele se esgueiraria para as trincheiras para sufocar os soldados e forçá-los a emergir..
Desinfetante

As soluções cloradas, aquelas em que o gás cloro foi dissolvido em água e depois tornado alcalino com um tampão, têm excelentes propriedades desinfetantes, bem como inibem a putrefação do tecido. Eles têm sido usados para desinfetar feridas abertas para eliminar bactérias patogênicas.
A água da piscina é precisamente clorada para eliminar bactérias, micróbios e parasitas que podem se hospedar nela. Antigamente era utilizado cloro gasoso para essa finalidade, porém sua ação é bastante agressiva. Em vez disso, são usadas soluções de hipoclorito de sódio (alvejante) ou comprimidos de ácido tricloroisocianúrico (TCA)..
O dito acima mostra que não é o Cldois aquele que exerce a ação desinfetante, mas HClO, ácido hipoclorito, que produz radicais O que destroem microorganismos.
Água sanitária
Muito semelhante à sua ação desinfetante, o cloro também alveja os materiais, pois os corantes responsáveis pelas cores são degradados pelo HClO. Assim, suas soluções cloradas são ideais para a remoção de manchas em roupas brancas, ou para o branqueamento da polpa de papel..
Policloreto de Vinila
O composto de cloro mais importante de todos, que responde por cerca de 19% da produção restante de cloro gasoso, é o cloreto de polivinila (PVC). Este plástico tem múltiplos usos. Com ele são feitos tubos de água, caixilhos de janelas, revestimentos de paredes e pisos, fiação elétrica, bolsas de soro, revestimentos, etc..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Cloro. Recuperado de: en.wikipedia.org
- Laura H. et al. (2018). Estrutura do cloro sólido em 1,45 GPaZeitschrift für Kristallographie. Materiais Cristalinos, Volume 234, Edição 4, Páginas 277-280, ISSN (Online) 2196-7105, ISSN (Imprimir) 2194-4946, DOI: doi.org/10.1515/zkri-2018-2145
- Centro Nacional de Informações sobre Biotecnologia. (2019). Cloro. Banco de dados PubChem. CID = 24526. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Marques Miguel. (s.f.). Cloro. Recuperado de: nautilus.fis.uc.pt
- Conselho Americano de Química. (2019). Química do Cloro: Introdução ao Cloro. Recuperado de: chlorine.americanchemistry.com
- Fong-Yuan Ma. (S.f.). Efeitos corrosivos dos cloretos nos metais. Departamento de Engenharia Marinha, NTOU República da China (Taiwan).
- Estado de Nova Iorque. (2019). Os fatos sobre o cloro. Recuperado de: health.ny.gov
- Dr. Doug Stewart. (2019). Fatos sobre o elemento cloro. Chemicool. Recuperado de: chemicool.com



Ainda sem comentários