
Fórmulas, características e usos do ácido hipossulfuroso
O ácido hipossulfuroso ou o ácido ditionoso é desconhecido, instável na forma pura, não tem existência independente e não foi detectado em solução aquosa.
Teoricamente, seria um ácido relativamente fraco, comparável ao ácido sulfuroso, H2SO3. Apenas seus sais são conhecidos, os ditionitos, que são agentes redutores estáveis e poderosos. O sal de sódio do ácido ditionico é ditionito de sódio.

- Fórmulas
| ácido ditionoso | ânion ditionita | ditionito de sódio | |
| Fórmulas | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 ácido hipossulfuroso (ou ditionoso)
- CAS: 14844-07-6 ácido hipossulfuroso (ou ditionoso, íon)
- CAS: 7775-14-6 ditionito de sódio (sal de sódio de ácido ditionoso)
Estrutura 2D
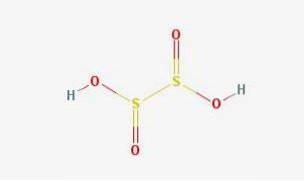
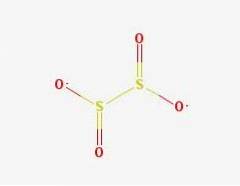
Estrutura 3D
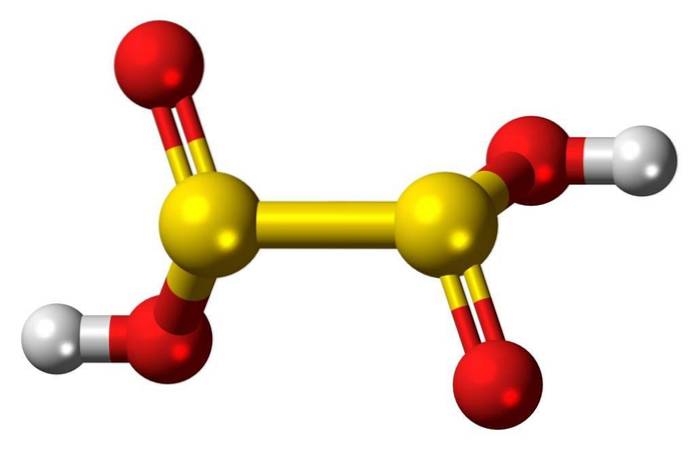
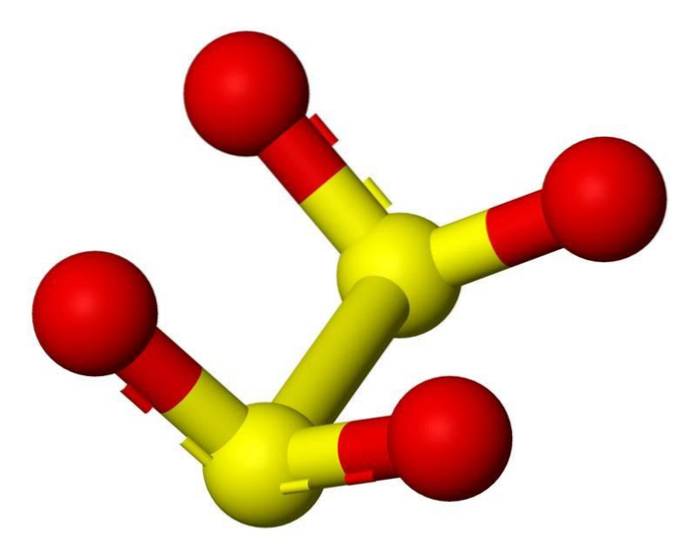
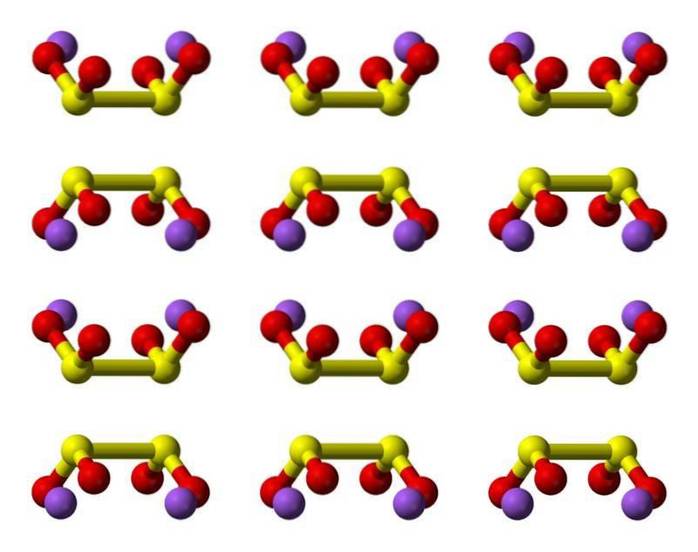
Caracteristicas
Propriedades físicas e químicas
| ácido ditionoso | ânion ditionita | ditionito de sódio | |
| Aparência: | . | . | Pó cristalino branco a esbranquiçado |
| . | . | Flocos de limão leves | |
| Odor: | . | . | Odor fraco de enxofre |
| Peso molecular: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Ponto de ebulição: | . | . | Se decompõe |
| Ponto de fusão: | . | . | 52 ° C |
| Densidade: | . | . | 2,38 g / cm3 (anidro) |
| Solubilidade em água | . | . | 18,2 g / 100 mL (anidro, 20 ° C) |
O ácido hipossulfuroso é um oxoácido de enxofre com a fórmula química H2S2O4.
Os oxoácidos de enxofre são compostos químicos que contêm enxofre, oxigênio e hidrogênio. No entanto, alguns deles são conhecidos apenas por seus sais (como ácido hipossulfuroso, ácido ditionico, ácido dissulfeto e ácido sulfuroso).
Entre as características estruturais dos oxoácidos que foram caracterizados temos:
- Enxofre tetraédrico quando coordenado com oxigênio
- Átomos de oxigênio ponte e terminal
- Grupos peroxo terminais
- Terminais S = S
- Strings de (-S-) n
O ácido sulfúrico é o oxoácido de enxofre mais conhecido e o mais importante industrialmente.
O ânion ditionito ([S2O4] 2-) é um oxoânion (um íon com a fórmula genérica AXOY z-) de enxofre formalmente derivado do ácido ditionico.
Os íons ditionita sofrem hidrólise ácida e alcalina em tiossulfato e bissulfito, e sulfito e sulfeto, respectivamente:
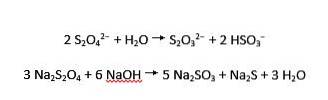
O sal de sódio do ácido ditionoso é ditionito de sódio (também conhecido como hidrossulfito de sódio).
O ditionito de sódio é um pó cristalino esbranquiçado a amarelo claro que tem um odor semelhante ao dióxido de enxofre..
Ele se aquece espontaneamente em contato com o ar e a umidade. Este calor pode ser suficiente para inflamar os materiais combustíveis circundantes..
Sob exposição prolongada ao fogo ou calor intenso, os recipientes deste material podem se romper violentamente..
É utilizado como agente redutor e branqueador. É utilizado e para branqueamento de celulose de papel e em tingimento. Ele também é usado para reduzir o grupo nitro a um grupo amino em reações orgânicas..
Embora estável na maioria das condições, ele se decompõe em água quente e soluções ácidas.
Pode ser obtido a partir do bissulfito de sódio pela seguinte reação:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Reações de ar e água
O ditionito de sódio é um sólido combustível que se decompõe lentamente ao entrar em contato com a água ou o vapor d'água, formando tiossulfatos e bissulfitos..
Esta reação produz calor, o que pode acelerar ainda mais a reação ou causar a queima dos materiais circundantes. Se a mistura for confinada, a reação de decomposição pode resultar na pressurização do recipiente, que pode se romper com força. Permanecendo no ar, oxida lentamente, gerando gases tóxicos de dióxido de enxofre.
Perigo de fogo
O ditionito de sódio é um material inflamável e combustível. Pode inflamar em contato com o ar úmido ou umidade. Pode queimar rapidamente com efeito de alargamento. Pode reagir vigorosa ou explosivamente em contato com água.
Pode se decompor de forma explosiva quando aquecido ou envolvido em fogo. Ele pode ser reacendido após o incêndio ser extinto. O escoamento pode criar risco de incêndio ou explosão. Os recipientes podem explodir quando aquecidos.
Perigo à saúde
Em contato com o fogo, o Ditionito de Sódio produzirá gases irritantes, corrosivos e / ou tóxicos. A inalação de produtos de decomposição pode causar ferimentos graves ou morte. O contato com a substância pode causar queimaduras graves na pele e nos olhos. O escoamento do controle de incêndio pode causar poluição.
Formulários
O íon ditionito é usado, muitas vezes em conjunto com um agente complexante (por exemplo, ácido cítrico), para reduzir o oxihidróxido de ferro (III) a compostos de ferro solúvel (II) e remover fases minerais amorfas contendo ferro (III) na análise do solo (extração seletiva ).
A ditionita aumenta a solubilidade do ferro. Graças à forte afinidade do íon ditionita para cátions metálicos bivalentes e trivalentes, ele é usado como um agente quelante..
A decomposição da ditionita produz espécies reduzidas de enxofre que podem ser muito agressivas para a corrosão do aço e do aço inoxidável..
Entre as aplicações do ditionito de sódio temos:
Na indústria
Este composto é um sal solúvel em água e pode ser usado como agente redutor em soluções aquosas. É usado como tal em alguns processos de tingimento industrial, principalmente aqueles envolvendo corantes de enxofre e corantes de cuba, nos quais um corante insolúvel em água pode ser reduzido a um sal de metal alcalino solúvel em água (por exemplo, o corante índigo).
As propriedades redutoras do ditionito de sódio também removem o excesso de corante, óxido residual e pigmentos indesejados, melhorando assim a qualidade geral da cor..
O ditionito de sódio também pode ser usado para tratamento de água, purificação de gás, limpeza e extração. Também pode ser utilizado em processos industriais como agente sulfonante ou fonte de íon sódio.
Além da indústria têxtil, este composto é utilizado em indústrias relacionadas a couro, alimentos, polímeros, fotografia, entre muitas outras. Também é usado como agente de branqueamento em reações orgânicas.
Nas ciências biológicas
O ditionito de sódio é frequentemente usado em experimentos de fisiologia como um meio de reduzir o potencial redox de soluções..
Nas ciências geológicas
O ditionito de sódio é frequentemente usado em experimentos de química do solo para determinar a quantidade de ferro que não é incorporado aos minerais de silicato primário..
Segurança e Riscos
Declarações de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (GHS)
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema internacionalmente aceito, criado pelas Nações Unidas e projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países, usando critérios consistentes globalmente..
As classes de perigo (e seu capítulo GHS correspondente), padrões de classificação e rotulagem e recomendações para ditionito de sódio são as seguintes (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):



Referências
- Benjah-bmm27, (2006). Um modelo ball-and-stick do íon ditionito [imagem] Recuperado de wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., & Steiger, T. (1998). Estruturas e energias de vários isômeros de ácido ditionoso, H2S2O4, e de seu ânion HS2O4-1. The Journal of Physical Chemistry A, 102 (6), 990-996. Recuperado de: mycrandall.ca
- Agência Europeia dos Produtos Químicos (ECHA). (2017). Resumo da classificação e rotulagem. Classificação harmonizada - Anexo VI do Regulamento (CE) n.º 1272/2008 (Regulamento CRE). Ditionito de sódio, hidrossulfito de sódio. Retirado em 2 de fevereiro de 2017, de: echa.europa.eu
- Jynto (conversa), (2011). Ditionous-acid-3D-balls [imagem] Recuperado de: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Amostra de ditionito de sódio [imagem] Recuperado de: wikipedia.org.
- Mills, B. (2009). Sódio-ditionito-xtal-1992-3D-balls [imagem] Recuperado de: wikipedia.org.
- Nações Unidas (2015). Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) Sexta edição revisada. Nova York, UE: Publicação das Nações Unidas. Recuperado de: unece.orgl
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2017). Ditionita. Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2017). Ácido ditionoso. Bethesda, MD, EU: National Library of Medicine. Recuperado de: nih.gov.
- Centro Nacional de Informações sobre Biotecnologia. PubChem Compound Database. (2017). Ditionito de sódio. Bethesda, MD, EU: National Library of Medicine. Recuperado de: nih.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados química. Ditionito de sódio. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov
- PubChem, (2016). Ditionita [imagem] Recuperado de: nih.gov.
- PubChem, (2016). Ditionita [imagem] Recuperado de: nih.gov.
- PubChem, (2016). Ácido ditionoso [imagem] Recuperado de: nih.gov.
- Wikipedia. (2017). Ditionita. Recuperado em 2 de fevereiro de 2017, em: wikipedia.org.
- Wikipedia. (2017). Dithionous_acid. Recuperado em 2 de fevereiro de 2017, em: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Recuperado em 2 de fevereiro de 2017, em: wikipedia.org.
- Wikipedia. (2017). Ditionito de sódio. Recuperado em 2 de fevereiro de 2017, em: wikipedia.org.
- Wikipedia. (2017). Oxoácido de enxofre. Recuperado em 2 de fevereiro de 2017, em: wikipedia.org.


Ainda sem comentários