
Características primárias do carbono, tipos e exemplos
O carbono primário É aquele que em qualquer composto, independentemente de seu ambiente molecular, forma uma ligação com pelo menos um outro átomo de carbono. Esta ligação pode ser simples, dupla (=) ou tripla (≡), desde que haja apenas dois átomos de carbono ligados e em posições adjacentes (logicamente).
Os hidrogênios presentes neste carbono são chamados de hidrogênios primários. No entanto, as características químicas dos hidrogênios primários, secundários e terciários diferem pouco e estão predominantemente sujeitas aos ambientes moleculares do carbono. É por esta razão que o carbono primário (1 °) é geralmente tratado com mais importância do que seus hidrogênios.
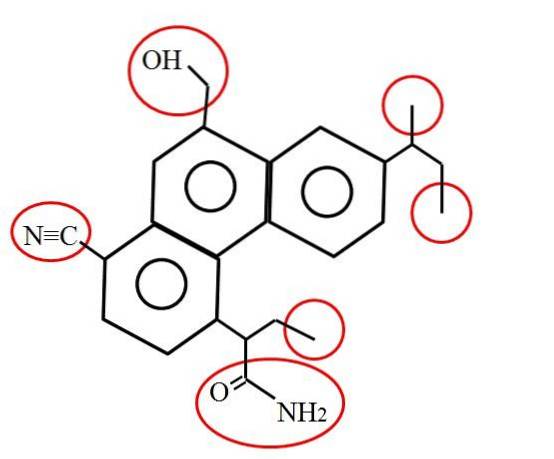
E como é um carbono primário? A resposta depende, como mencionado, do seu ambiente molecular ou químico. Por exemplo, a imagem acima indica os carbonos primários, entre círculos vermelhos, na estrutura de uma molécula hipotética (embora provavelmente real)..
Se você olhar com atenção, verá que três deles são idênticos; enquanto os outros três são totalmente diferentes. Os três primeiros consistem em grupos metil, -CH3 (à direita da molécula), e os outros são os grupos metilol, -CHdoisOH, nitrila, -CN e uma amida, RCONHdois (à esquerda da molécula e abaixo dela).
Índice do artigo
- 1 Características do carbono primário
- 1.1 Localização e links
- 1.2 Baixo impedimento estérico
- 1.3 Reatividade
- 2 tipos
- 3 exemplos
- 3.1 Aldeídos e ácidos carboxílicos
- 3.2 Em aminas lineares
- 3.3 Em haletos de alquila
- 4 referências
Características do carbono primário
Localização e links
Seis carbonos primários foram mostrados acima, sem nenhum comentário além de suas localizações e quais outros átomos ou grupos os acompanham. Eles podem estar em qualquer parte da estrutura e, onde quer que estejam, marcam o "fim da estrada"; isto é, onde termina uma seção do esqueleto. É por isso que às vezes são chamados de carbonos terminais..
Assim, é óbvio que os grupos -CH3 eles são terminais e seu carbono é 1 °. Observe que esse carbono se liga a três hidrogênios (que foram omitidos na imagem) e a um único carbono, completando suas respectivas quatro ligações..
Portanto, todos são caracterizados por terem uma ligação C-C, uma ligação que também pode ser dupla (C = CHdois) ou triplo (C≡CH). Isso permanece verdadeiro mesmo se houver outros átomos ou grupos ligados a esses carbonos; como com os outros três carbonos 1 ° restantes na imagem.
Impedimento estérico baixo
Foi mencionado que os carbonos primários são terminais. Ao sinalizar o fim de um trecho do esqueleto, nenhum outro átomo está interferindo espacialmente com eles. Por exemplo, os grupos -CH3 eles podem interagir com átomos de outras moléculas; mas suas interações com átomos vizinhos da mesma molécula são baixas. O mesmo se aplica ao -CHdoisOH e -CN.
Isso ocorre porque eles estão praticamente expostos ao "vácuo". Portanto, geralmente apresentam baixo impedimento estérico em relação aos demais tipos de carbono (2º, 3º e 4º).
Porém, há exceções, o produto de uma estrutura molecular com muitos substituintes, alta flexibilidade ou tendência a se fechar sobre si mesmo..
Reatividade
Uma das consequências do menor impedimento estérico em torno do 1º carbono é uma maior exposição para reagir com outras moléculas. Quanto menos átomos obstruírem o caminho da molécula de ataque em sua direção, mais provável será sua reação..
Mas, isso é verdade apenas do ponto de vista estérico. Na verdade, o fator mais importante é o eletrônico; ou seja, qual é o ambiente dos referidos carbonos 1 °.
O carbono adjacente ao primário transfere parte de sua densidade eletrônica para ele; e o mesmo pode acontecer na direção oposta, favorecendo certo tipo de reação química.
Assim, os fatores estérico e eletrônico explicam porque geralmente é o mais reativo; embora, não haja realmente uma regra de reatividade global para todos os carbonos primários.
Tipos
Os carbonos primários carecem de uma classificação intrínseca. Em vez disso, eles são classificados com base nos grupos de átomos aos quais pertencem ou aos quais estão ligados; Esses são os grupos funcionais. E uma vez que cada grupo funcional define um tipo específico de composto orgânico, existem diferentes carbonos primários.
Por exemplo, o grupo -CHdoisOH é derivado do álcool primário RCHdoisOH. Os álcoois primários, portanto, consistem em 1 ° carbonos ligados ao grupo hidroxila, -OH.
O grupo nitrila, -CN ou -C≡N, por outro lado, só pode ser ligado diretamente a um átomo de carbono pela única ligação C-CN. Assim, a existência de nitrilas secundárias (RdoisCN) ou muito menos terciário (R3CN).
Um caso semelhante ocorre com o substituinte derivado da amida, -CONHdois. Ele pode sofrer substituições dos hidrogênios do átomo de nitrogênio; mas seu carbono só pode se ligar a outro carbono e, portanto, sempre será considerado como primário, C-CONHdois.
E com relação ao grupo -CH3, É um substituto de alquila que só pode se ligar a outro carbono, sendo, portanto, primário. Se o grupo etil for considerado, -CHdoisCH3, será imediatamente notado que o CHdois, grupo metileno, é um carbono 2 ° porque está ligado a dois carbonos (C-CHdoisCH3).
Exemplos
Aldeídos e ácidos carboxílicos
Foi feita menção a alguns exemplos de carbonos primários. Além deles, existe o seguinte par de grupos: -CHO e -COOH, denominados formila e carboxila, respectivamente. Os carbonos desses dois grupos são primários, pois sempre formarão compostos com as fórmulas RCHO (aldeídos) e RCOOH (ácidos carboxílicos).
Este par está intimamente relacionado um ao outro devido às reações de oxidação que o grupo formil sofre para se transformar em carboxil:
RCHO => RCOOH
Reação sofrida por aldeídos ou o grupo -CHO se for como um substituinte em uma molécula.
Em aminas lineares
A classificação das aminas depende exclusivamente do grau de substituição dos hidrogênios do grupo -NHdois. No entanto, em aminas lineares podem ser observados carbonos primários, como na propanamina:
CH3-CHdois-CHdois-NHdois
Observe que o CH3 será sempre um primeiro carbono, mas desta vez o CHdois à direita também está 1 °, uma vez que está ligado a um único carbono e ao grupo NHdois.
Em haletos de alquila
Um exemplo muito semelhante ao anterior é dado com os halogenetos de alquila (e em muitos outros compostos orgânicos). Suponha que o bromopropano:
CH3-CHdois-CHdois-Br
Nele, os carbonos primários permanecem os mesmos.
Em conclusão, os carbonos 1 ° transcendem o tipo de composto orgânico (e mesmo organometálico), pois podem estar presentes em qualquer um deles e são identificados simplesmente por estarem ligados a um único carbono.
Referências
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10º edição.). Wiley plus.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison, R. T. e Boyd, R. N. (1987). Quimica Organica. (5ta Edição). Editorial Addison-Wesley Interamericana.
- Ashenhurst J. (16 de junho de 2010). Primário, Secundário, Terciário, Quaternário em Química Orgânica. Master Organic Chemistry. Recuperado de: masterorganicchemistry.com
- Wikipedia. (2019). Carbono primário. Recuperado de: en.wikipedia.org



Ainda sem comentários