
Estrutura, propriedades, nomenclatura e usos dos álcoois
O álcoois são compostos orgânicos que se caracterizam por possuírem um grupo hidroxila (-OH) ligado a um carbono saturado; ou seja, um carbono que está ligado a quatro átomos por ligações simples (sem ligações duplas ou triplas).
A fórmula genérica para esta vasta e versátil família de compostos é ROH. Para ser considerado um álcool no sentido estritamente químico, o grupo OH deve ser o mais reativo na estrutura molecular. Isso é importante para podermos afirmar, entre várias moléculas com grupos OH, qual delas é um álcool..

Um dos álcoois quintessenciais e mais conhecido na cultura popular é o álcool etílico ou etanol, CH3CHdoisOH. Dependendo de sua origem natural e, portanto, de seu ambiente químico, suas misturas podem originar um espectro ilimitado de sabores; alguns, que até mostram mudanças positivas no paladar com a mosca dos anos.
São as misturas de compostos orgânicos e inorgânicos com o álcool etílico, o que dá origem ao seu consumo em eventos sociais e religiosos desde tempos anteriores a Cristo; como com vinho de uva, ou com copos servidos para uma festa, além de ponches, doces, panetones, etc..
O desfrute dessas bebidas, com moderação, é resultado da sinergia entre o álcool etílico e sua matriz química envolvente; sem ele, como uma substância pura, torna-se extremamente perigoso e desencadeia uma série de consequências negativas para a saúde.
É por esta razão que o consumo de misturas aquosas de CH3CHdoisOH, como aqueles comprados em farmácias para fins anti-sépticos, representa um grande risco para o corpo.
Outros álcoois também muito populares são o mentol e o glicerol. Este último, assim como o eritrol, é encontrado como aditivo em muitos alimentos para adoçá-los e preservá-los durante o armazenamento. Existem entidades governamentais que ditam quais álcoois podem ser usados ou consumidos sem efeitos colaterais..
Deixando para trás o uso diário dos álcoois, quimicamente são substâncias muito versáteis, pois a partir deles, outros compostos orgânicos podem ser sintetizados; a ponto de alguns autores pensarem que com uma dúzia deles todos os compostos necessários podem ser criados para viver em uma ilha deserta..
Índice do artigo
- 1 Estrutura dos álcoois
- 1.1 Caráter anfifílico
- 1.2 Estrutura de R
- 2 Propriedades físicas e químicas
- 2.1 Ponto de ebulição
- 2.2 Capacidade de solvente
- 2.3 Anfoterismo
- 3 Nomenclatura
- 3.1 Nome comum
- 3.2 Sistema IUPAC
- 4 Síntese
- 4.1 Hidratação de alcenos
- 4.2 Processo Oxo
- 4.3 Fermentação de carboidratos
- 5 usos
- 5.1 Bebidas
- 5.2 Matéria-prima química
- 5,3 Solventes
- 5,4 Combustíveis
- 5.5 Anti-sépticos
- 5.6 Outros usos
- 6 referências
Estrutura dos álcoois
Os álcoois têm uma fórmula geral de ROH. O grupo OH está ligado ao grupo alquil R, cuja estrutura varia de um álcool para outro. A união entre R e OH é por meio de uma única ligação covalente, R-OH.
A imagem a seguir mostra três estruturas genéricas para álcoois, lembrando que o átomo de carbono está saturado; ou seja, ele forma quatro links simples.
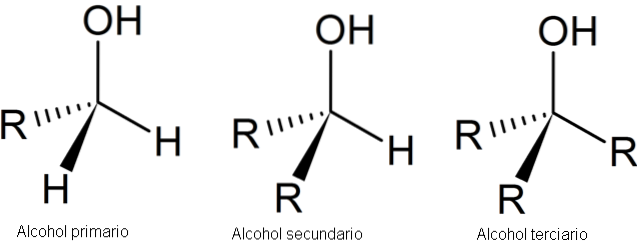
Como pode ser visto, R pode ser qualquer esqueleto de carbono, desde que não tenha substituintes mais reativos do que o grupo OH..
Para o caso do álcool primário, primeiro, o grupo OH está ligado a um carbono primário. Isso é facilmente verificado observando-se que o átomo no centro do tetraedro esquerdo está ligado a um R e dois H.
O álcool secundário, 2º, é verificado com o carbono do tetraedro no centro agora ligado a dois grupos R e um H.
E por fim, existe o álcool terciário, 3º, com o carbono ligado a três grupos R.
Caráter anfifílico
Dependendo do tipo de carbono ligado ao OH, existe a classificação dos álcoois primários, secundários e terciários. Nos tetraedros, as diferenças estruturais entre eles já foram detalhadas. Mas, todos os álcoois, independentemente de sua estrutura, compartilham algo em comum: o caráter anfifílico..
Você não precisa abordar uma estrutura para notá-la, apenas sua fórmula química ROH. O grupo alquil é composto quase inteiramente de átomos de carbono, "montando" uma estrutura hidrofóbica; ou seja, ele interage muito fracamente com a água.
Por outro lado, o grupo OH pode formar ligações de hidrogênio com moléculas de água, sendo, portanto, hidrofílico; ou seja, ama ou tem afinidade com a água. Assim, os álcoois têm uma estrutura hidrofóbica, ligada a um grupo hidrofílico. São apolares e polares ao mesmo tempo, o que equivale a dizer que são substâncias anfifílicas.
R-OH
(Hidrofóbico) - (Hidrofílico)
Como será explicado na próxima seção, o caráter anfifílico dos álcoois define algumas de suas propriedades químicas..
Estrutura de R
O grupo alquil R pode ter qualquer estrutura, mas é importante, pois permite que os álcoois sejam catalogados.
Por exemplo, R pode ser uma cadeia aberta, como é o caso do etanol ou do propanol; ramificado, como álcool t-butílico, (CH3)doisCHCHdoisOH; pode ser cíclico, como no caso do ciclohexanol; ou pode ter um anel aromático, como no álcool benzílico, (C6H5) CHdoisOH, ou em 3-fenilpropanol, (C6H5) CHdoisCHdoisCHdoisOh.
A cadeia R pode até ter substituintes como halogênios ou ligações duplas, como para os álcoois 2-cloroetanol e 2-Buten-1-ol (CH3CHdois= CHCHdoisOH).
Considerando então a estrutura de R, a classificação dos álcoois torna-se complexa. Por este motivo, a classificação baseada na sua estrutura (1º, 2º e 3º álcoois) é mais simples, mas menos específica, embora seja suficiente para explicar a reatividade dos álcoois..
Propriedades físicas e químicas
Ponto de ebulição
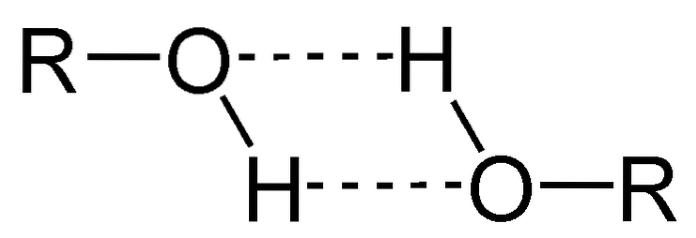
Uma das principais propriedades dos álcoois é que eles se associam por meio de ligações de hidrogênio..
Na imagem acima, você pode ver como duas moléculas de ROH formam ligações de hidrogênio uma com a outra. Graças a isso, os álcoois são geralmente líquidos com alto ponto de ebulição..
Por exemplo, o álcool etílico tem um ponto de ebulição de 78,5 ° C. Esse valor aumenta à medida que o álcool fica mais pesado; ou seja, o grupo R tem uma massa ou número de átomos maior. Assim, álcool n-butílico, CH3CHdoisCHdoisCHdoisOH, tem ponto de ebulição de 97ºC, ligeiramente inferior ao da água.
O glicerol é um dos álcoois com maior ponto de ebulição: 290ºC.
Por quê? Porque não apenas a massa ou estrutura de R influencia, mas também o número de grupos OH. O glicerol possui três OH's em sua estrutura: (HO) CHdoisCH (OH) CHdois(OH). Isso o torna capaz de formar muitas ligações de hidrogênio e manter suas moléculas juntas com mais força..
Por outro lado, alguns álcoois são sólidos à temperatura ambiente; como o mesmo glicerol a uma temperatura abaixo de 18ºC. Portanto, a afirmação de que todos os álcoois são substâncias líquidas está incorreta..
Capacidade de solvente
Nas residências é muito comum recorrer ao uso de álcool isopropílico para remover uma mancha de difícil remoção em uma superfície. Esta capacidade solvente, muito útil para síntese química, deve-se ao seu caráter anfifílico, explicado anteriormente..
As gorduras caracterizam-se por serem hidrofóbicas: por isso é difícil removê-las com água. No entanto, ao contrário da água, os álcoois têm uma parte hidrofóbica em sua estrutura.
Assim, seu grupo alquil R interage com as gorduras, enquanto o grupo OH forma ligações de hidrogênio com a água, ajudando a deslocá-las..
Anfoterismo
Os álcoois podem reagir como ácidos e bases; ou seja, são substâncias anfotéricas. Isso é representado pelas seguintes duas equações químicas:
ROH + H+ => ROHdois+
ROH + OH- => RO-
RO- é a fórmula geral do que é conhecido como um alcóxido.
Nomenclatura
Existem duas maneiras de nomear álcoois, cuja complexidade dependerá de sua estrutura.
Nome comum
Os álcoois podem ser chamados por seus nomes comuns. Quais são? Para isso, o nome do grupo R deve ser conhecido, ao qual a desinência -ico é adicionada, e é precedido pela palavra 'álcool'. Por exemplo, o CH3CHdoisCHdoisOH é álcool propílico.
Outros exemplos são:
-CH3OH: álcool metílico
-(CH3)doisCHCHdoisOH: álcool isobutílico
-(CH3)3COH: álcool terc-butílico
Sistema IUPAC
Quanto aos nomes comuns, você deve começar identificando R. A vantagem desse sistema é que ele é muito mais preciso do que o outro..
R, sendo um esqueleto de carbono, pode ter ramificações ou várias cadeias; a cadeia mais longa, ou seja, com mais átomos de carbono, é aquela que receberá o nome de álcool.
Ao nome do alcano da cadeia mais longa, a terminação 'l' é adicionada. É por isso que no CH3CHdoisOH é chamado de etanol (CH3CHdois- + OH).
Geralmente, o OH deve ter a enumeração mais baixa possível. Por exemplo, o BrCHdoisCHdoisCHdois(OH) CH3 é chamado de 4-bromo-2-butanol, e não 1-bromo-3-butanol.
Síntese
Hidratação de alceno
O processo de craqueamento do óleo produz uma mistura de alquenos de quatro ou cinco átomos de carbono, que podem ser facilmente separados.
Esses alcenos podem ser convertidos em álcoois pela adição direta de água ou pela reação do alceno com ácido sulfúrico, seguida da adição da água que cliva o ácido, dando origem ao álcool..
Processo oxo
Na presença de um catalisador adequado, os alcenos reagem com o monóxido de carbono e o hidrogênio para gerar aldeídos. Os aldeídos podem ser facilmente reduzidos a álcoois por uma reação de hidrogenação catalítica.
Freqüentemente, ocorre tal sincronização do processo oxo que a redução dos aldeídos é quase simultânea com sua formação..
O catalisador mais utilizado é o dicobalto octocarbonil, obtido pela reação entre cobalto e monóxido de carbono..
Fermentação de carboidratos
A fermentação de carboidratos por leveduras ainda é de grande importância na produção de etanol e outros álcoois. Os açúcares vêm da cana-de-açúcar ou do amido obtido de diferentes grãos. Por esse motivo, o etanol também é chamado de "álcool de grãos"
Formulários
Bebidas
Embora não seja a principal função dos álcoois, a presença do etanol em algumas das bebidas é um dos conhecimentos mais populares. Assim, o etanol, produto da fermentação da cana-de-açúcar, uva, maçã etc., está presente em inúmeras bebidas de consumo social..
Matéria-prima química
-O metanol é utilizado na produção do formaldeído, por meio de sua oxidação catalítica. O formaldeído é usado na fabricação de plásticos, tintas, têxteis, explosivos, etc..
-O butanol é usado na produção de etanoato de butano, um éster usado como aromatizante na indústria de alimentos e confeitaria..
-O álcool alílico é usado na produção de ésteres, incluindo dialilftalato e dialilisoftalato, que servem como monômeros.
-O fenol é utilizado na produção de resinas, fabricação de náilon, desodorantes, cosméticos, etc..
-Álcoois com uma cadeia linear de 11-16 átomos de carbono são usados como intermediários para obter plastificantes; por exemplo, cloreto de polivinila.
-Os chamados álcoois graxos são usados como intermediários na síntese de detergentes.
Solventes
-O metanol é usado como diluente de tinta, assim como o 1-butanol e o álcool isobutílico.
-O álcool etílico é usado como solvente para muitos compostos insolúveis em água, sendo usado como solvente em tintas, cosméticos, etc..
-Os álcoois graxos são usados como solventes na indústria têxtil, em corantes, em detergentes e em tintas. O isobutanol é usado como solvente em materiais de revestimento, tintas e adesivos.
Combustíveis
-O metanol é usado como combustível em motores de combustão interna e um aditivo de gasolina para melhorar a combustão.
-O álcool etílico é usado em combinação com combustíveis fósseis em veículos motorizados. Para tanto, extensas regiões do Brasil são destinadas ao cultivo de cana-de-açúcar para a produção de álcool etílico. Esse álcool tem a vantagem de produzir apenas dióxido de carbono em sua combustão..
Quando o álcool etílico é queimado, ele produz uma chama limpa e sem fumaça, razão pela qual é usado como combustível em cozinhas de campo..
-O álcool gelificado é produzido pela combinação de metanol ou etanol com acetato de cálcio. Este álcool é usado como fonte de calor em fogões de campo e, como derrama, é mais seguro do que os álcoois líquidos.
-O chamado biobutanol é usado como combustível nos transportes, assim como o álcool isopropílico que pode ser usado como combustível; embora seu uso não seja recomendado.
Anti-sépticos
O álcool isopropílico na concentração de 70% é usado como um anti-séptico externo para eliminar os germes e retardar seu crescimento. Da mesma forma, o álcool etílico é usado para este propósito..
Outros usos
Ciclohexanol e metilciclohexanol são usados em acabamento têxtil, processamento de móveis e tira-manchas.
Referências
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. Aminas. (10º edição.). Wiley plus.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Dr. JA Colapret. (s.f.). Álcoois. Recuperado de: colapret.cm.utexas.edu
- The Alcohol Pharmacology Education Partnership. (s.f.). O que é álcool? Universidade Duke. Recuperado de: sites.duke.edu
- Whittemore F. (s.f.). Tipos e usos do álcool. Recuperado de: livestrong.com
- Wikipedia. (2018). Álcool. Recuperado de: en.wikipedia.org



Ainda sem comentários