
50 exemplos de ácidos e bases

São centenas exemplos de ácidos e bases que podem ser encontrados em todos os ramos da química, mas que, como um todo, são separados em duas grandes famílias: inorgânica e orgânica. Os ácidos inorgânicos são geralmente conhecidos como ácidos minerais, caracterizados por serem especialmente fortes em comparação com os orgânicos..
Ácidos e bases são entendidos como substâncias que possuem sabores azedo ou saponáceo, respectivamente. Ambos são corrosivos, embora a palavra 'cáustico' seja freqüentemente usada para bases fortes. Resumindo: eles queimam e corroem a pele se tocados. Suas características em dissolver mídias guiaram uma série de definições ao longo da história..
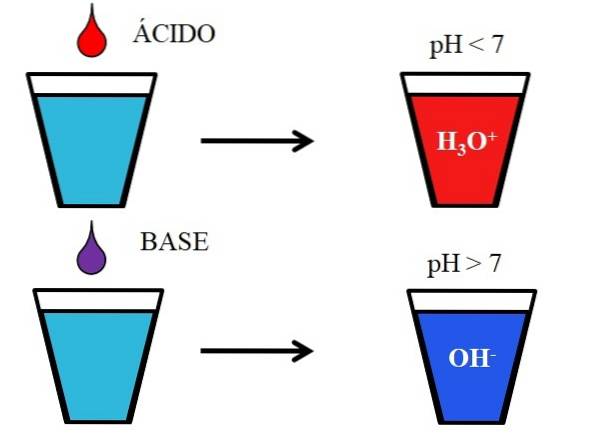
A imagem abaixo mostra o comportamento genérico de ácidos e bases quando são adicionados ou dissolvidos em um copo de água. Os ácidos produzem soluções com valores de pH abaixo de 7 devido aos íons hidrônio, H3OU+; enquanto as bases produzem soluções com pH acima de 7 devido aos íons hidroxila (ou hidroxila), OH-.
Se adicionarmos ácido clorídrico, HCl (gota vermelha), ao vidro, haverá íons H3OU+ e Cl- hidratado. Por outro lado, se repetirmos o experimento com hidróxido de sódio, NaOH (gota roxa), teremos íons OH- e Na+.
Índice do artigo
- 1. Definições
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 exemplos de ácidos
- 3 exemplos de bases
- 4 referências
Definições

As características cada vez mais estudadas e compreendidas dos ácidos e bases estabeleceram mais de uma definição para esses compostos químicos. Entre essas definições, temos a de Arrhenius, Bronsted-Lowry e, finalmente, a de Lewis. Antes de citar os exemplos, é necessário ser claro sobre isso.
Arrhenius
Ácidos e bases, segundo Arrhenius, são aqueles que, quando dissolvidos em água, produzem íons H3OU+ ou OH-, respectivamente. Ou seja, a imagem já representa essa definição. No entanto, por si só, ele negligencia alguns ácidos ou bases muito fracos para produzir tais íons. É aqui que entra a definição de Bronsted-Lowry..
Bronsted-Lowry
Ácidos de Bronsted-Lowry são aqueles que podem doar íons H+, e as bases são aquelas que aceitam estes H+. Se um ácido doa facilmente seu H+, significa que é um ácido forte. O mesmo acontece com as bases, mas aceitando H+.
Assim, temos ácidos e bases fortes ou fracos, e suas forças são medidas em diferentes solventes; especialmente em água, a partir da qual as unidades de pH conhecidas são estabelecidas (de 0 a 14).
Portanto, um ácido forte HA doará totalmente o seu H+ à água em uma reação do tipo:
HA + HdoisO => A- + H3OU+
Para onde- é a base conjugada de HA. Daí vem o H3OU+ presente no vidro com solução ácida.
Enquanto isso, uma base fraca B irá desprotonar a água para ganhar seu respectivo H+:
B + HdoisOU <=> HB + OH-
Onde HB é o ácido conjugado de B. Este é o caso da amônia, NH3:
NH3 + HdoisOU <=> NH4+ + Oh-
Uma base muito forte pode doar íons OH diretamente- sem a necessidade de reagir com água; assim como NaOH.
Lewis
Finalmente, os ácidos de Lewis são aqueles que ganham ou aceitam elétrons, e as bases de Lewis são aquelas que doam ou perdem elétrons..
Por exemplo, a base de Bronsted-Lowry NH3 É também uma base de Lewis, uma vez que o átomo de nitrogênio aceita um H+ ao doar seu par de elétrons livres (H3N: H+) Por isso, as três definições não divergem entre si, mas se entrelaçam e ajudam a estudar a acidez e a basicidade em um espectro mais amplo de compostos químicos..
Exemplos de ácidos
Esclarecidas as definições, uma série de ácidos com suas respectivas fórmulas e nomes serão mencionados a seguir:
-HF: ácido fluorídrico
-HBr: ácido bromídrico
-HI: ácido iodídrico
-HdoisS: sulfeto de hidrogênio
-HdoisSe: ácido selenídrico
-HdoisChá: ácido telurídrico
Estes são os ácidos binários, também chamados de hidrácidos, aos quais pertence o referido ácido clorídrico, HCl.
-HNO3: Ácido nítrico
-HNOdois: ácido nitroso
-HNO: ácido hiponítrico
-HdoisCO3: ácido carbónico
-HdoisCOdois: ácido carbonáceo, que na verdade é mais conhecido pelo nome de ácido fórmico, HCOOH, o ácido orgânico mais simples de todos
-H3PO4: ácido fosfórico
-H3PO3 ou Hdois[HPO3]: ácido fosforoso, com uma ligação H-P
-H3POdois ou H [HdoisPOdois]: ácido hipofosforoso, com duas ligações H-P
-HdoisSW4: ácido sulfúrico
-HdoisSW3: ácido sulfuroso
-HdoisSdoisOU7: ácido dissulfúrico
-HIO4: ácido periódico
-HIO3: ácido iódico
-HIOdois: ácido iodo
-HIO: ácido de hipoiodo
-HdoisCrO4: ácido crômico
-HMnO4: ácido mangânico
-CH3COOH: ácido acético (vinagre)
-CH3SW3H: ácido metanossulfônico
Todos esses ácidos, exceto fórmico e os dois últimos, são conhecidos como oxácidos ou ácidos ternários..
Outras:
-AlCl3: cloreto de alumínio
-FeCl3: cloreto férrico
-BF3: trifluoreto de boro
-Cátions metálicos dissolvidos em água
-Carbocações
-H (CHBonzeClonze): carborano superácido
- FSO3H: ácido fluorossulfônico
- HSbF6: ácido fluoroantimônico
- FSO3H SbF5: ácido mágico
Os últimos quatro exemplos constituem os temíveis superácidos; compostos capazes de desintegrar quase qualquer material apenas com seu toque. AlCl3 é um exemplo de ácido de Lewis, já que o centro metálico do alumínio é capaz de aceitar elétrons devido à sua deficiência eletrônica (não completa seu octeto de valência).
Exemplos de bases
Dentre as bases inorgânicas, temos os hidróxidos metálicos, como o hidróxido de sódio, e alguns hidretos moleculares, como a amônia já mencionada. Aqui estão outros exemplos de bases:
-KOH: hidróxido de potássio
-LiOH: hidróxido de lítio
-RbOH: hidróxido de rubídio
-CsOH: hidróxido de césio
-FrOH: hidróxido de frâncio
-Be (OH)dois: hidróxido de berílio
-Mg (OH)dois: hidróxido de magnésio
-Ca (OH)dois: hidróxido de cálcio
-Sr (OH)dois: hidróxido de estrôncio
-Ba (OH)dois: hidróxido de bário
-Ra (OH)dois: hidróxido de rádio
-Fe (OH)dois: hidróxido ferroso
-Fe (OH)3: hidróxido férrico
-Al (OH)3: hidróxido de alumínio
-Pb (OH)4: hidróxido de chumbo
-Zn (OH)dois: hidróxido de zinco
-Cd (OH)dois: hidróxido de cádmio
-Cu (OH)dois: hidróxido cúprico
-Ti (OH)4: hidróxido titânico
-PH3: fosfina
-Cinzas3: arsine
-NaNHdois: amida de sódio
- C5H5N: piridina
-(CH3) N: trimetilamina
- C6H5NHdois: fenilamina ou anilina
-NaH: hidreto de sódio
-KH: hidreto de potássio
-Carbanions
-Li3N: nitreto de lítio
-Alcóxidos
-[(CH3)doisCH]doisNLi: diisopropilamida de lítio
-Ânion dietinilbenzeno: C6H4C4dois- (a base mais forte conhecida até agora)
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Naomi Hennah. (10 de outubro de 2018). Como ensinar ácidos, bases e sais. Recuperado de: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31 de agosto de 2019). Fórmulas de ácidos e bases comuns. Recuperado de: Thoughtco.com
- David Wood. (2019). Comparando Ácidos e Bases Comuns. Estudar. Recuperado de: study.com
- Ross Pomeroy. (23 de agosto de 2013). Os ácidos mais fortes do mundo: como fogo e gelo. Recuperado de: realclearscience.com
- Wikipedia. (2019). Dianião de dietinilbenzeno. Recuperado de: en.wikipedia.org


Ainda sem comentários