
Estrutura, propriedades, riscos e usos do óxido de etileno
O óxido de etileno É um composto orgânico da família dos epóxidos. À temperatura ambiente é gasoso, incolor e, embora quase inodoro, apresenta um odor suave e adocicado, semelhante ao dos éteres..
É um bloco de construção químico muito versátil, pois é utilizado em uma ampla variedade de aplicações industriais para a fabricação de outros compostos químicos de múltiplos usos. Isso se deve à sua alta reatividade, ou seja, sua facilidade de reagir com outras substâncias..
Uma de suas principais aplicações é como matéria-prima na fabricação de componentes anticongelantes para radiadores de veículos. Seus derivados são utilizados como ingredientes em produtos de limpeza industrial ou doméstica, produtos cosméticos e xampus, plastificantes, preparações farmacêuticas ou pomadas..
É um desinfetante amplamente utilizado, por exemplo, na esterilização de equipamentos médicos e odontológicos, pois é capaz de destruir vírus, bactérias, fungos e esporos, principalmente em ambientes secos. Além disso, tem sido utilizado para fumigar produtos alimentícios para embalagens, embora seu uso seja questionado..
Apesar de sua utilidade, deve ser manuseado com extrema cautela, pois pode causar irritação nos olhos e na pele. A inalação de óxido de etileno por longos períodos pode afetar o sistema nervoso. Portanto, as pessoas que forem expostas aos seus vapores ou soluções devem usar equipamentos e roupas de proteção..
Índice do artigo
- 1 Estrutura
- 2 propriedades
- 2.1 Outros nomes
- 2.2 Estado físico
- 2.3 Peso molecular
- 2.4 Ponto de fulgor
- 2,5 Densidade
- 2.6 Solubilidade
- 2.7 Temperatura de autoignição
- 2.8 Outras propriedades
- 3 Produção
- 4 riscos
- 4.1 Para a saúde
- 4.2 Fogo
- 5 usos
- 5.1 Aplicações industriais
- 5.2 Aplicações médicas
- 5.3 Bibliotecas e museus
- 5.4 Agricultura e alimentação
- 6 referências
Estrutura
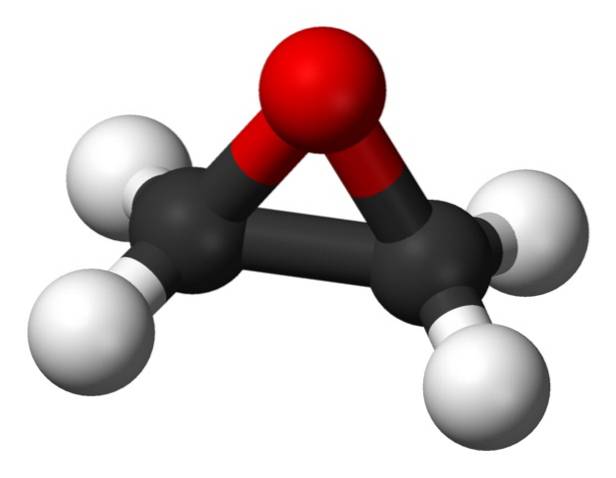
Sua fórmula molecular é CdoisH4O. Pertence ao grupo dos epóxidos, sendo o mais simples e o mais importante deles. Tem a forma de um anel de três membros.
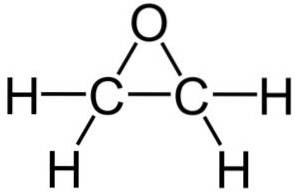
Devido à sua estrutura em anel triangular, o óxido de etileno é muito reativo, o que se deve à facilidade com que o anel se abre. Em média, os ângulos das ligações são de 60 °, o que as torna fracas. A molécula é menos estável do que a de um éter linear e tende a reagir facilmente com outros compostos químicos..
Propriedades
Outros nomes
- Oxirano.
- Epoxietano.
Estado físico
À temperatura ambiente e sob pressão atmosférica, é um gás. Abaixo de 10,6 ºC e sob pressão atmosférica, é um líquido. Abaixo de -111 ºC é um sólido.
Peso molecular
44,05 g / mol.
Ponto de inflamação
Menos de 0ºF (-17,8ºC).
Densidade
Sua densidade é menor que a da água, sendo 0,882 a 10 ºC. Por sua vez, seus vapores são mais pesados que o ar.
Solubilidade
É solúvel em água, benzeno, acetona, etanol e éter. É miscível com tetracloreto de carbono.
Temperatura de autoignição
428,9 ºC.
Outras propriedades
- Se sujeito a aquecimento ou contaminação, pode polimerizar exotermicamente (produzindo grande quantidade de calor). Se a polimerização ocorrer dentro de um recipiente, ela pode se romper violentamente.
- Pode reagir com materiais oxidantes.
- É extremamente tóxico, cancerígeno e um bom gerador de mutações em bactérias e células de mamíferos..
Produção
Em escala industrial, é preparado oxidando etileno com oxigênio (Odois) do ar. A velocidade dessa reação aumenta com a presença do metal prata (Ag) e com a ação da temperatura. A reação é mostrada abaixo:
Ag, 250ºC
2 CdoisH4 + OUdois -> 2CdoisH4OU
Etileno óxido de etileno
Riscos
Para a saúde
- Foi relatado que causa distúrbios neurológicos e pode causar a morte. A menor concentração que pode gerar efeitos tóxicos por inalação é de 12.500 ppm / 10 segundos (ppm significa: partes por milhão).
- É um forte irritante para a pele, olhos e trato respiratório..
- A exposição a vapores de óxido de etileno em alta concentração pode causar irritação nos olhos, inflamação da membrana do olho e danos à córnea..
- O desenvolvimento de catarata tem sido associado à exposição a seus vapores e respingos. Soluções concentradas causam graves danos aos olhos.
- O contato de soluções aquosas de óxido de etileno com a pele causa irritação e pode levar a dermatites graves com bolhas e queimaduras..
- A inalação pode afetar o sistema nervoso, causando dores de cabeça e náuseas, entre outros sintomas..
Incêndio
- Quando exposto a chamas ou calor, existe o perigo de explosão. Quando aquecido, gases perigosos são gerados.
- O vapor forma misturas explosivas com o ar em uma ampla gama de concentrações.
- Evite manuseá-lo com equipamentos que contenham metais como cobre, prata, mercúrio, magnésio, óxidos de alumínio ou ferro, além de evitar agentes como amônia, agentes oxidantes, ácidos ou bases orgânicas, entre outros. Todos esses materiais podem acelerar sua polimerização e / ou explosão.
Formulários
Aplicações industriais
É utilizado como intermediário na produção de outros produtos químicos, que por sua vez são utilizados na fabricação de fibras de poliéster para roupas, estofados, tapetes e travesseiros..
O óxido de etileno produz o etilenoglicol usado no anticongelante de motores de veículos. O etilenoglicol também é usado na fabricação de filmes para embalagens de fibra de vidro e plástico..
Outros produtos químicos produzidos a partir do óxido de etileno incluem surfactantes não iônicos usados em detergentes e fórmulas para lavagem de louças..
Aplicações médicas
É utilizado como agente esterilizante de equipamentos médicos, como instrumentos cirúrgicos, agulhas e injetores hipodérmicos ou próteses.
Também é utilizado para esterilizar máquinas de hemodiálise, equipamentos de laboratório, instrumentos odontológicos, instrumentos veterinários, termômetros, roupas cirúrgicas ou equipamentos de primeiros socorros, entre outros..

Embora existam vários métodos disponíveis para a esterilização de equipamentos médicos, em alguns usos nenhum tratamento disponível pode substituir o óxido de etileno..
É o caso da esterilização de certos materiais sensíveis ao calor e à radiação, bem como de alguns instrumentos e aparelhos que requerem esterilização no local de uso em hospitais..
Bibliotecas e museus
Nesses locais, o óxido de etileno é utilizado no controle de pragas como fungos e insetos. No entanto, esse uso não é tão comum e é usado quando outras alternativas não são eficazes..
Agricultura e alimentação
Tem sido utilizado como pesticida, fungicida, fumigante, herbicida, inseticida, rodenticida, entre outras variantes. Reduz significativamente a população de bactérias e fungos em especiarias.
No entanto, devido a questões de segurança e ambientais, o uso de óxido de etileno para fumigação de alimentos foi proibido na União Europeia e nos Estados Unidos..
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Óxido de etileno. Recuperado de pubchem.ncbi.nlm.nih.gov
- Fatos de segurança química. (2019). Óxido de etileno. Recuperado de chemicalsafetyfacts.org
- Morrison, Robert Thornton; e Boyd, Robert Neilson. 1992. Organic Chemistry. Prentice-Hall.
- Moerman, F. e Mager, K. (2016). Limpeza e desinfecção em instalações de processamento de alimentos secos. No manual de controle de higiene na indústria de alimentos (segunda edição). Recuperado de sciendirect.com.
- Eastmond, David A. e Balakrishnan, Sharada. (2010). Genotoxicidade de Pesticidas. Em Hayes 'Handbook of Pesticide Toxicology (Terceira edição). Recuperado de sciencedirect.com
- Atungulu, G.G. e Pan, Z. (2012). Descontaminação microbiana de nozes e especiarias. In Microbial Decontamination in the Food Industry. Recuperado de sciencedirect.com


Ainda sem comentários